
Wetenschap
Hoe vind je de pH van twee verbindingen die samen worden gegeven?
Waarom u pH -waarden niet direct kunt toevoegen:
* pH is een logaritmische schaal: PH meet de concentratie van waterstofionen (H+) in een oplossing. De pH -schaal is logaritmisch, wat betekent dat elke gehele getalverandering een tienvoudige verandering in H+ -concentratie vertegenwoordigt.
* Veranderingen mengen Concentraties: Wanneer u twee verbindingen mengt, veranderen hun individuele H+ -concentraties. De uiteindelijke pH hangt af van de relatieve hoeveelheden van elke verbinding en hun zure of basissterktes.
Hoe de pH van een mengsel te vinden:
1. Identificeer de verbindingen:
* zuren: Doneer H+ ionen (bijv. HCl, HNO3, H2SO4)
* Bases: Accepteer H+ ionen (bijv. NaOH, Koh, NH3)
* neutraal: Beïnvloeden de pH (bijv. Suiker, zout) niet significant
2. Bepaal hun concentraties: U moet de initiële molaire concentraties van elke verbinding in het mengsel kennen.
3. Bereken de nieuwe concentraties:
* neutralisatie: Als een zuur en base worden gemengd, zullen ze reageren. Bereken de hoeveelheid zuur en base die reageren om water (H2O) en een zout te vormen. Dit heeft invloed op de uiteindelijke concentraties van het resterende zuur of de basis.
* verdunning: Als u een verbinding met water verdunt, zal de concentratie van de verbinding afnemen.
4. Bereken de pH:
* Sterke zuren en basen: Gebruik de volgende vergelijkingen:
* pH =-log [H+] (voor sterke zuren)
* poh =-log [oh-] (voor sterke bases)
* pH + poh =14 (om pH te vinden van POH)
* Zwakke zuren en basen: Gebruik de evenwichtsconstante (ka of kb) voor de zuur of basis en de ijs (initiële, verandering, evenwicht) tabelmethode om de H+ of OH-concentratie te berekenen en vervolgens de pH te vinden.
Voorbeeld:
Laten we zeggen dat u 50 ml 0,1 M HCl (een sterk zuur) mengt met 50 ml 0,1 M NaOH (een sterke basis).
1. Neutralisatie: HCL en NaOH reageren volledig in een verhouding van 1:1 om water (H2O) en NaCl (zout) te vormen.
2. Eindconcentraties: Omdat de volumes gelijk zijn, neutraliseren het zuur en de basis elkaar volledig. De uiteindelijke oplossing zal neutraal zijn, met een pH van 7.
Sleutelpunten:
* Beschouw altijd de sterke punten van de betrokken zuren en basen.
* Als u met zwakke zuren of basen werkt, zijn de berekeningen complexer.
* Als het mengsel meerdere zuren of basen omvat, moet u meer geavanceerde evenwichtsberekeningen gebruiken.
Als u specifieke verbindingen en hun concentraties biedt, kan ik u helpen de pH van het mengsel te berekenen.
 Waar is de Sierra-sneeuw dit voorjaar gebleven? Niet in Californische rivieren en watervoorzieningen
Waar is de Sierra-sneeuw dit voorjaar gebleven? Niet in Californische rivieren en watervoorzieningen  Hoe vulkanen de aardkorst recyclen om zeldzame metalen bloot te leggen die essentieel zijn voor groene technologie
Hoe vulkanen de aardkorst recyclen om zeldzame metalen bloot te leggen die essentieel zijn voor groene technologie Suomi NPP Satellite ziet Hilary op de rand van de status van grote orkaan
Suomi NPP Satellite ziet Hilary op de rand van de status van grote orkaan NASA-enquêtetechniek schat de koolstof in Congo-bossen
NASA-enquêtetechniek schat de koolstof in Congo-bossen Hoe stadsleven te omarmen, maar vermijd een apocalyps
Hoe stadsleven te omarmen, maar vermijd een apocalyps
Hoofdlijnen
- Wat is de wetenschappelijke naam of taxonomische classificatie van giftige plantaardige paardenboon?
- Een taxonomische categorie tussen koninkrijk en klasse is.
- Wat is de meest gebruikelijke manier om bacteriën te laten groeien?
- Welk concept bevat de gen-chromosoomtheorie?
- Waarom was het belangrijk voor Mendel om grote aantallen planten te tellen?
- Wat is de betekenis van reproductie?
- Nieuwe studie gooit de orthodoxie over de manier waarop macrofagen bacteriën doden omver
- Wat veroorzaakt een breed scala aan fenotypes voor sommige eigenschappen?
- Onderzoekers bepalen hoe type II restrictie-endonuclease Sau3AI DNA splitst
- Eenvoudige methode voor op keramiek gebaseerde flexibele elektrolytplaten voor lithium-metaalbatterijen

- Negatieve ontwerpstrategieën voor thermische uitzetting in metaal-organische raamwerken

- Nieuwe katalysator geeft een boost aan de volgende generatie EV-batterijen
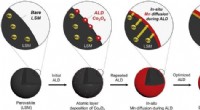
- Nieuwe composietkatalysator belooft een kosteneffectieve conversie van ethanol naar vliegtuigbrandstof

- Onderzoekers creëren efficiënte semisynthese van biofarmaceutische-Fc-conjugaten
 Onboarding nieuwe telewerkbanen in tijden van corona
Onboarding nieuwe telewerkbanen in tijden van corona Studie bevestigt magnetische eigenschappen van silicium nano-linten
Studie bevestigt magnetische eigenschappen van silicium nano-linten Sally laat een spoor van vernieling achter over de Golfkust
Sally laat een spoor van vernieling achter over de Golfkust De voordelen van gespreide begin- en eindtijden van de school
De voordelen van gespreide begin- en eindtijden van de school Toenemende dominantie van diatomeeën in het estuarium van de Pearl River
Toenemende dominantie van diatomeeën in het estuarium van de Pearl River Wat is de beweging van deeltjes in een vloeistof?
Wat is de beweging van deeltjes in een vloeistof?  Multifunctionele siliciumchip gemaakt voor de verwerking van kwantuminformatie
Multifunctionele siliciumchip gemaakt voor de verwerking van kwantuminformatie Nieuwe techniek zet antilichamen efficiënt om in sterk afgestemde nanobodies
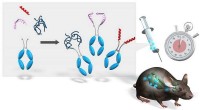
Nieuwe techniek zet antilichamen efficiënt om in sterk afgestemde nanobodies
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

