
Wetenschap
Kunnen overgangsmetalen al hun elektronen doneren?
* Elektronenconfiguratie: Overgangsmetalen hebben een unieke elektronenconfiguratie waarbij hun D-orbitalen worden gevuld. Ze hebben meestal een gedeeltelijk gevulde D-orbitale schaal. Hoewel ze wat elektronen kunnen verliezen van hun buitenste S-orbitale en D-orbitale, is het volledig legen van het D-orbitaal energetisch ongunstig.
* stabiliteit: Overgangsmetalen bereiken over het algemeen stabiliteit door ionen te vormen met verschillende ladingen, afhankelijk van het specifieke metaal en de situatie. Ze willen van beide voldoende elektronen verliezen:
* Bereik een edelgasconfiguratie (zoals het verliezen van twee elektronen om een +2 ion te vormen).
* Maak een half gevulde of volledig gevulde D-orbital, die stabielere configuraties zijn.
* Voorbeelden:
* ijzer (Fe): Kan Fe
2+
vormen (twee elektronen verliezen) of Fe
3+
(drie elektronen verliezen), maar zelden Fe
8+
(alle acht valentie -elektronen verliezen).
* koper (cu): Kan cu
+
vormen (één elektron verliezen) of cu
Uitzonderingen:
Hoewel zeldzaam, zijn er enkele gevallen waarin overgangsmetalen formeel al hun valentie -elektronen kunnen doneren. Dit gebeurt vaak in hoge oxidatietoestanden en onder extreme omstandigheden, zoals:
* Hoge oxidatietoestanden: MnO 4 bijvoorbeeld
* Complexe verbindingen: Sommige complexe verbindingen met overgangsmetalen kunnen ongebruikelijke oxidatietoestanden vertonen, waardoor mogelijk de donatie van alle valentie -elektronen nodig is.
Conclusie: Overgangsmetalen doneren meestal slechts enkele van hun elektronen om stabiele ionen te vormen, gericht op configuraties die de stabiliteit maximaliseren. Ze doneren zelden al hun valentie -elektronen.
 Heeft het rode licht van gloeiende neongas slechts één frequentie of een mengsel van frequenties?
Heeft het rode licht van gloeiende neongas slechts één frequentie of een mengsel van frequenties?  Hoe breng je CUCL CL2 - CUCL2 in evenwicht?
Hoe breng je CUCL CL2 - CUCL2 in evenwicht?  Verdubbelt het verdubbelen van de zuur- en baseconcentraties in een neutralisatiereactie de hoeveelheid warmte die vrijkomt?
Verdubbelt het verdubbelen van de zuur- en baseconcentraties in een neutralisatiereactie de hoeveelheid warmte die vrijkomt?  Wat is het smelt- en kookpunt van zinkoxide?
Wat is het smelt- en kookpunt van zinkoxide?  Waterdamp uit uw mond laten komen
Waterdamp uit uw mond laten komen
Hoofdlijnen
- De (blanco) gevonden in de nucleaire envelop zijn bekleed met gespecialiseerde eiwitten die het transport van stoffen in en uit de kern mogelijk maken?
- Wetenschappers ontdekken bossen die de klimaatverandering kunnen weerstaan
- Wat zijn 5 voorbeelden van meiose?
- Zouden twee broers hetzelfde DNA hebben?
- Hoe bacteriën hun celcyclus controleren
- Mysterie opgelost? Biologen vinden een unieke versie van filamentvormend eiwit in menselijke cellen die insecten niet hebben
- Atomair zicht op cellulaire pomp laat zien hoe bacteriën eiwitten uitzenden
- Wat maakt ons mens?
- Waarom groeit schimmels op fruit en brood?
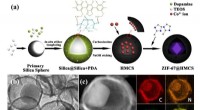
- MOF @ holle mesoporeuze koolstofbollen als bifunctionele elektrokatalysatoren
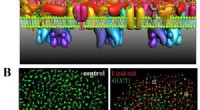
- Beeldvorming met superresolutie onthult het mechanisme van GLUT1-clustering
- Complexe moleculen maken in slechts een paar stappen

- Cafeïne vertraagt de beweging van watermoleculen

- Het tweaken van de structuur van een molecuul kan het een ander pad naar kristallisatie sturen

 De levenscyclus van grizzlyberen
De levenscyclus van grizzlyberen  Hoe vogels in zwermen vliegen
Hoe vogels in zwermen vliegen Schadelijke chemische stof die wordt geproduceerd aan bacteriën?
Schadelijke chemische stof die wordt geproduceerd aan bacteriën?  Welke objecten hebben wetenschappers in staat om de ruimte in te sturen?
Welke objecten hebben wetenschappers in staat om de ruimte in te sturen?  Hoeveel joule aan energie krijgt een boek van 1 Newton als het 4 meter omhoog wordt gebracht?
Hoeveel joule aan energie krijgt een boek van 1 Newton als het 4 meter omhoog wordt gebracht?  Wat is de ecologische voetafdruk van een ziekenhuisbed?
Wat is de ecologische voetafdruk van een ziekenhuisbed?  IBM introduceert nieuwe grafeentransistor
IBM introduceert nieuwe grafeentransistor Welk golflengtebereik in het elektromagnetische spectrum is het meest bruikbaar gebleken onderzoek naar stergeboorte dichte moleculaire wolken?
Welk golflengtebereik in het elektromagnetische spectrum is het meest bruikbaar gebleken onderzoek naar stergeboorte dichte moleculaire wolken?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

