
Wetenschap
Hoe verschillen moleculen dan ionen of atomen?
atomen
* De bouwstenen: Atomen zijn de fundamentele eenheden van materie. Ze bestaan uit een kern (bevattende protonen en neutronen) omgeven door een wolk van elektronen.
* Basiseenheden: Ze zijn de kleinste eenheid van een element dat de chemische eigenschappen van dat element behoudt.
* Voorbeelden: Waterstof (H), zuurstof (O), koolstof (C)
moleculen
* Twee of meer atomen aan elkaar verbonden: Moleculen worden gevormd wanneer twee of meer atomen chemisch aan elkaar binden.
* stabiele eenheden: Ze zijn over het algemeen stabiel en hebben hun eigen unieke eigenschappen.
* Voorbeelden: Water (H₂o), kooldioxide (CO₂), glucose (c₆h₁₂o₆)
ionen
* geladen atomen of moleculen: Ionen worden gevormd wanneer een atoom- of molecuul een of meer elektronen verliest of verliest, wat resulteert in een netto elektrische lading.
* kationen en anionen: Als een atoom elektronen verliest, wordt het positief geladen en wordt het een kation genoemd. Als een atoom elektronen krijgt, wordt het negatief geladen en wordt het een anion genoemd.
* Voorbeelden: Natriumion (Na⁺), chloride -ion (Cl⁻), sulfaation (So₄²⁻)
Belangrijkste verschillen in een tabel:
| Feature | Atomen | Moleculen | Ionen |
| --- | --- | --- | --- |
| Definitie | Fundamentele eenheden van materie | Twee of meer atomen aan elkaar verbonden | Geladen atomen of moleculen |
| Laad | Neutraal | Neutraal | Positief of negatief |
| voorbeelden | Waterstof (h), zuurstof (o) | Water (H₂o), koolstofdioxide (CO₂) | Natriumion (Na⁺), chloride -ion (CL⁻) |
| stabiliteit | Kan onafhankelijk bestaan | Over het algemeen stabiel | Over het algemeen stabiel |
| binding | Niet van toepassing | Covalente of ionische bindingen | Niet van toepassing (behalve in ionische verbindingen) |
Belangrijke opmerking:
* ionische verbindingen worden gevormd wanneer kationen en anionen elkaar aantrekken vanwege hun tegengestelde kosten. Deze verbindingen zijn technisch gezien niet "moleculen" omdat ze niet het delen van elektronen (covalente binding) omvatten.
* polyatomische ionen zijn ionen die meer dan één atoom bevatten. Het sulfaation (SO₄²⁻) bestaat bijvoorbeeld uit één zwavelatoom en vier zuurstofatomen.
Laat het me weten als je nog meer vragen hebt!
 Kunnen we het koolstofgehalte van landbouwbodems verhogen?
Kunnen we het koolstofgehalte van landbouwbodems verhogen?  Hoe te converteren van Mollen per liter naar percentage
Hoe te converteren van Mollen per liter naar percentage  Wat is de formule van ionen gevormd wanneer calcium een pseudo-noble-gas-configuratie bereikt?
Wat is de formule van ionen gevormd wanneer calcium een pseudo-noble-gas-configuratie bereikt?  Ionen die worden gebruikt om een rustpotentieel vast te stellen?
Ionen die worden gebruikt om een rustpotentieel vast te stellen?  Hoe kan ozon zowel goed als slecht zijn?
Hoe kan ozon zowel goed als slecht zijn?
 Multi-universitair centrum streeft naar minimalisering van mijnafvalrisico
Multi-universitair centrum streeft naar minimalisering van mijnafvalrisico Wat zijn een climax -gemeenschap die wordt gedomineerd door grassen?
Wat zijn een climax -gemeenschap die wordt gedomineerd door grassen?  Wat is het verschil tussen een habitat en gemeenschap?
Wat is het verschil tussen een habitat en gemeenschap?  Booreilanden kunnen uitstoot onder de Noordzee pompen
Booreilanden kunnen uitstoot onder de Noordzee pompen Greenpeace slaat alarm over plasticvervuiling in rivieren
Greenpeace slaat alarm over plasticvervuiling in rivieren
Hoofdlijnen
- Negen verdwaalde olifanten geëlektrocuteerd in Botswana
- Plantencellen kunnen glucose niet veranderen in zetmeel.
- DNA en RNA leveren bewijs van evolutie omdat?
- Wat is de evolutionaire ladder op orde?
- Hoe fruitvliegjes CO₂ ruiken:Onderzoek identificeert individuele receptoren en hoe deze te blokkeren
- Welke functie presteert lysosomen in een cel?
- Hoe een 'dirigent' betekenis geeft aan chaos in vroege muizenembryo's
- Biologen volgen DNA-parasieten in de jacht op ziektebehandelingen
- De zeer specifieke moleculaire schaar die DNA snijden worden opgeroepen?
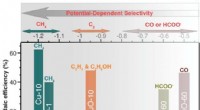
- Selectieve katalysatoren voor recycling van kooldioxide
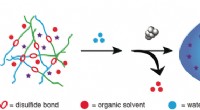
- Zelfvernietigde redox-gevoelige stomatocyt nanomotor levert en geeft medicijnen vrij voor cellen
- Chemicus die elektrische velden bestudeert, microfluïdica om de dialysetechnologie te verbeteren

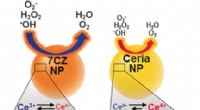
- Ceria-zirconia-nanodeeltjes als verbeterde multi-antioxidanten zijn effectief bij de behandeling van sepsis
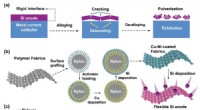
- Wetenschappers stellen een flexibel interface-ontwerp voor een silicium-grafiet dual-ion batterij voor
 Wat zijn de namen van de vier buitenplaneten in het zonnestelsel?
Wat zijn de namen van de vier buitenplaneten in het zonnestelsel?  Prestatiedoorbraak door topologische isolator in een golfgeleider-resonatorsysteem
Prestatiedoorbraak door topologische isolator in een golfgeleider-resonatorsysteem Brand in de zone van Tsjernobyl, Kiev zegt dat stralingsniveaus veilig zijn
Brand in de zone van Tsjernobyl, Kiev zegt dat stralingsniveaus veilig zijn Onderzoek toont mechanisme achter slijtage op atomaire schaal
Onderzoek toont mechanisme achter slijtage op atomaire schaal Feiten over functies voor algebra 1
Feiten over functies voor algebra 1  Nieuw optisch apparaat op waterbasis zorgt voor een revolutie op het gebied van optisch onderzoek
Nieuw optisch apparaat op waterbasis zorgt voor een revolutie op het gebied van optisch onderzoek Pandemie schudt ranglijst van meest leefbare steden ter wereld door elkaar
Pandemie schudt ranglijst van meest leefbare steden ter wereld door elkaar Wat is het proces waarbij DNA wordt gedupliceerd?
Wat is het proces waarbij DNA wordt gedupliceerd?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

