
Wetenschap
Wat is het belangrijkste idee van vaste vloeistof en gas?
Hier is een uitsplitsing:
* vaste stoffen: Deeltjes zijn stevig verpakt in een vaste, reguliere opstelling , met sterke krachten die hen bij elkaar houden. Dit resulteert in een definitieve vorm en volume , en minimale beweging. Denk aan een blok ijs of een rots.
* vloeistoffen: Deeltjes zijn dicht bij elkaar, maar beweeg vrij , constant veranderende positie. Ze hebben een definitief volume maar geen duidelijke vorm , de vorm aannemen van hun container. Denk aan water in een glas of een plas.
* gassen: Deeltjes zijn ver uit elkaar , snel en willekeurig bewegen met zwakke krachten tussen hen. Dit betekent dat ze geen duidelijke vorm of volume hebben , uitbreiden om hun container te vullen. Denk aan lucht of helium in een ballon.
Het sleutelverschil Tussen deze staten is de mate van vrijheid De deeltjes moeten bewegen. Deze vrijheid is direct gerelateerd aan de temperatuur , die de hoeveelheid energie beïnvloedt die de deeltjes bezitten.
* Verwarming Een stof verhoogt deeltjesergie, waardoor ze sneller bewegen en overstappen van vaste naar vloeistof (smelten) en vervolgens vloeistof naar gas (koken).
* koeling Een stof vermindert deeltjesergie, waardoor ze langzamer bewegen en overgaan van gas naar vloeistof (condensatie) en vervolgens vloeistof naar vaste (bevriezen).
Dus het hoofdidee is dat de toestand van materie wordt gedefinieerd door de opstelling, beweging en energie van zijn samenstellende deeltjes. Dit begrip is van fundamenteel belang om het gedrag van materie in onze wereld te begrijpen.
 Wat zijn de koninkrijken die meercellige organismen bevatten?
Wat zijn de koninkrijken die meercellige organismen bevatten?  De toekomst van hazelnoten:de economische waarde van subseizoensvoorspellingen
De toekomst van hazelnoten:de economische waarde van subseizoensvoorspellingen De winter begint te laat in het normaal koude, landelijke Alaska
De winter begint te laat in het normaal koude, landelijke Alaska Hoe u klimaatverandering kunt voorspellen vanuit uw luie stoel
Hoe u klimaatverandering kunt voorspellen vanuit uw luie stoel Welke stof is het minst overvloedig in de sfeer?
Welke stof is het minst overvloedig in de sfeer?
Hoofdlijnen
- Lignine-afval aangepast voor industrieel gebruik van bio-olie
- Zijn schimmelcelnulceus aanwezig of afwezig?
- Wat voor soort spinachtige is parasitair en kan worden gevonden bij mensen?
- Produceert mitose cellen die van elkaar verschillen?
- Is evolutie intelligenter dan we dachten?
- Wat is een homologe expressiesysteem?
- Wat zit er in een naam? In sommige gevallen een langere levensduur
- Zijn koffieboerderijen voor de vogels? Ja en nee
- Welke positieve effecten hebben mensen op inktvis?
- Leren van de rijkdom van de natuur:nieuwe bibliotheken voor het ontdekken van medicijnen
- Natuur-imiterende coating maakt batterijen duurzamer en efficiënter
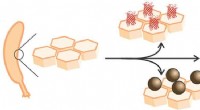
- Engineering woonsteigers voor bouwmaterialen
- Verbeterde katalysator kan zich vertalen in winst in de petrochemische productie

- Was aan, wegsmelten

 Heeft waar studenten opgroeien invloed op waar ze naar de universiteit gaan?
Heeft waar studenten opgroeien invloed op waar ze naar de universiteit gaan? Wanneer waterstofchloride in water wordt opgelost om zoutzuur te vormen, wat gebeurt er het chloride?
Wanneer waterstofchloride in water wordt opgelost om zoutzuur te vormen, wat gebeurt er het chloride?  De voordelen van halfgeleiders
De voordelen van halfgeleiders  Wetenschappers identificeren bijdragen van verticale atmosferische metingen en simulaties tijdens nevelvervuiling in Beijing
Wetenschappers identificeren bijdragen van verticale atmosferische metingen en simulaties tijdens nevelvervuiling in Beijing  Leg uit wat de rode verschuiving in achtergrondstraling van Big Bang ons vertelt?
Leg uit wat de rode verschuiving in achtergrondstraling van Big Bang ons vertelt?  Chronische dysenterie was waarschijnlijk niet de moordenaar van Edward Black Prince, ondanks wat algemeen wordt aangenomen
Chronische dysenterie was waarschijnlijk niet de moordenaar van Edward Black Prince, ondanks wat algemeen wordt aangenomen  Facebook neemt Britse ex-vice-premier aan als hoofd Global Affairs
Facebook neemt Britse ex-vice-premier aan als hoofd Global Affairs 9/11 bereidde bedrijven voor op economische effecten van COVID-19
9/11 bereidde bedrijven voor op economische effecten van COVID-19
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

