
Wetenschap
Hebben ionische verbindingen verschillende eigenaardigheden dan de elementen waaruit ze zijn gemaakt?
Belangrijkste verschillen:
* Staat van materie: Veel ionische verbindingen zijn vast bij kamertemperatuur, terwijl de elementen die ze verzinnen vaste stoffen, vloeistoffen of gassen kunnen zijn. Natrium (NA) is bijvoorbeeld een zacht, zilverachtig metaal en chloor (CL) is een groenachtig geel gas, maar natriumchloride (NaCl) is een witte, kristallijne vaste stof (tafelzout).
* smelt- en kookpunten: Ionische verbindingen hebben over het algemeen hoge smelt- en kookpunten vanwege de sterke elektrostatische krachten die de ionen bij elkaar houden. De elementen die ze vormen, hebben daarentegen meestal veel lagere smeltende en kookpunten.
* elektrische geleidbaarheid: Ionische verbindingen leiden elektriciteit wanneer opgelost in water of gesmolten. Dit komt omdat de ionen vrij zijn om te verplaatsen en lading te dragen. De elementen die hen vormen, zijn vaak slechte geleiders van elektriciteit in hun elementaire vorm.
* Oplosbaarheid: Ionische verbindingen hebben een variërende oplosbaarheid in verschillende oplosmiddelen, die vaak oplossen in polaire oplosmiddelen zoals water. De elementen die ze vormen, kunnen verschillende oplosbaarheidspatronen hebben.
* brosheid: Ionische verbindingen zijn vaak bros, wat betekent dat ze gemakkelijk onder druk breken. De elementen die ze vormen, kunnen meer kneedbaar of ductiel zijn.
Waarom het verschil?
Het significante verschil in eigenschappen komt voort uit de aard van ionische binding . In ionische verbindingen winnen of verliezen atomen elektronen, die geladen ionen vormen. Deze ionen worden bij elkaar gehouden door sterke elektrostatische attracties. Deze sterke attractie creëert een rigide, kristallijne structuur met hoge smelt- en kookpunten.
Voorbeeld:
Overweeg natriumchloride (NaCl):
* Natrium (NA) verliest gemakkelijk een elektron om een positief ion te vormen (Na+).
* Chloor (CL) krijgt gemakkelijk een elektron om een negatief ion te vormen (Cl-).
* De tegengesteld geladen ionen trekken elkaar sterk aan en vormen een kristallijne structuur met hoge smelt- en kookpunten.
Samenvattend:
Ionische binding leidt tot significante veranderingen in fysische en chemische eigenschappen in vergelijking met de afzonderlijke elementen die de verbinding vormen.
Hoofdlijnen
- Bacterieel model helpt onthullen hoe ons lichaam bevolkingsexplosies – en kanker – voorkomt
- Wat leidt er af. Wetenschap?
- Organismen in de koninkrijken eubacteria en archaebacteriën waren eerder gegroepeerd op een koninkrijk genaamd?
- Wat doodde Knut de ijsbeer? Studie biedt 'afsluiting'
- Wat is een andere naam voor gemeenschap van organismen?
- Studie krijgt inzicht in hoe zoogdieren het gehoor ontwikkelden
- Is een slak single of multi -celled?
- Nieuw onderzoek laat zien hoe wetenschappers sociale media gebruiken
- Kunstmatige intelligentie lost conflicten op die onderzoek naar diergedrag belemmeren
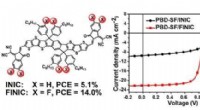
- Onderzoekers ontwikkelen elektronenacceptor met gefuseerde ring met 3D-exciton en ladingstransport
- Moleculair jodium katalyseert processen voor antivirale en farmaceutische syntheses
- Plunger, espresso, filter? Alleen omdat je koffie bitter is, wil nog niet zeggen dat hij sterker is

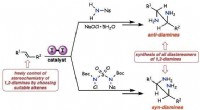
- Wereldprimeur voor het lezen van digitaal gecodeerde synthetische moleculen
- Bio-hernieuwbaar proces kan groen plastic helpen

 Raspberry Pi 4:Blogger vindt wegversperring oplader
Raspberry Pi 4:Blogger vindt wegversperring oplader Met een TENG, zonnecellen kunnen werken, regen of zonneschijn
Met een TENG, zonnecellen kunnen werken, regen of zonneschijn Gegevensgestuurde verkiezingen en de belangrijkste vragen over kiezerstoezicht
Gegevensgestuurde verkiezingen en de belangrijkste vragen over kiezerstoezicht Doorbraak in ultrasnelle gegevensverwerking op nanoschaal
Doorbraak in ultrasnelle gegevensverwerking op nanoschaal Vertragingen in draadloze netwerken verminderen
Vertragingen in draadloze netwerken verminderen Welke twee dingen heeft elke villus?
Welke twee dingen heeft elke villus?  Welk stadium komt op de eerste plaats in de levenscyclus van een lage massaster?
Welk stadium komt op de eerste plaats in de levenscyclus van een lage massaster?  Wat is primaire rusttijd?
Wat is primaire rusttijd?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


