
Wetenschap
Wat is het effect van toevoeging Een katalysator op de chemische reacties van snelheid?
Wat is een katalysator?
Een katalysator is een stof die een chemische reactie versnelt zonder tijdens het proces te worden geconsumeerd. Het doet dit door een alternatieve reactieroute te bieden met een lagere activeringsenergie.
Hoe katalysatoren werken:
* Lagere activeringsenergie: Katalysatoren verlagen de activeringsenergie van een reactie. Dit is de minimale hoeveelheid energie die reactantmoleculen moeten botsen om effectief met elkaar te botsen en producten te vormen. Door de activeringsenergie te verlagen, hebben meer moleculen voldoende energie om te reageren, wat leidt tot een snellere reactiesnelheid.
* Biedt een alternatief pad: Katalysatoren bieden een andere route voor de reactie om door te gaan, waarbij vaak tussenstappen worden gebruikt die gemakkelijker te overwinnen zijn dan het oorspronkelijke pad.
* Het verhogen van de frequentie van effectieve botsingen: Katalysatoren kunnen ook de frequentie van effectieve botsingen tussen reactantmoleculen verhogen door ze dichter bij elkaar te brengen of ze te oriënteren op een manier die de reactie bevordert.
belangrijke opmerkingen:
* katalysatoren worden niet geconsumeerd: Katalysatoren zijn geen reactanten en worden niet opgebruikt tijdens de reactie. Ze kunnen deelnemen aan het reactiemechanisme, maar worden uiteindelijk geregenereerd.
* katalysatoren veranderen het evenwicht niet: Katalysatoren beïnvloeden alleen de snelheid van een reactie, niet de uiteindelijke evenwichtspositie. De evenwichtsconstante (k) blijft hetzelfde.
* Specifieke katalysatoren voor specifieke reacties: Verschillende reacties vereisen verschillende katalysatoren, omdat het mechanisme en de activeringsenergiebarrières variëren.
Voorbeelden van katalysatoren:
* enzymen: Biologische katalysatoren die biochemische reacties in levende organismen versnellen.
* metalen: Sommige metalen, zoals platina en palladium, fungeren als katalysatoren in verschillende industriële processen.
* zuren: Zuren kunnen werken als katalysatoren voor bepaalde reacties, zoals verestering.
Conclusie: Katalysatoren zijn essentieel voor veel chemische reacties en versnellen hun tarieven zonder in het proces te worden geconsumeerd. Ze bieden alternatieve paden met lagere activeringsenergieën, wat leidt tot snellere reactiesnelheden.
 Scholen gesloten wegens gezondheidsnood terwijl smog de hoofdstad van India bedekt
Scholen gesloten wegens gezondheidsnood terwijl smog de hoofdstad van India bedekt Orkaan Delta treft Mexico, gaat richting de VS
Orkaan Delta treft Mexico, gaat richting de VS Hoe natuurbranden een waterscheiding in Yosemite herstelden
Hoe natuurbranden een waterscheiding in Yosemite herstelden  Europese kunststofindustrie in de problemen door dalend marktaandeel
Europese kunststofindustrie in de problemen door dalend marktaandeel  Twee jaar aftellen voor diepzeebodemmijnbouw
Twee jaar aftellen voor diepzeebodemmijnbouw
Hoofdlijnen
- Wat is de diameter van DNA Double Helix?
- Welke dieren eten tandvleesbomen?
- Wat is logaritmische groei in cellen?
- Onderzoekers ontdekken hoe mitochondriën om hulp vragen als ze onder stress staan
- Welke celonderdelen hebben plantcellen, maar dieren bevatten niet?
- Wat is fotosynthetisch membraan?
- Wat zijn de zeven niveaus die wetenschappers gebruiken om organismen te classificeren?
- Wie is de persoon die bekwaam is in de wetenschap van planten?
- Welke twee bollen komen chemicaliën in de ecosystemen?
- Flexibel, stabiel en krachtig tegen kanker - nieuwe benadering van tumorbehandeling
- Nieuwe biochemische route die meer veerkrachtige gewasvariëteiten kan ontwikkelen

- Verschillen in vetweefsel lichtreflecterende eigenschappen zorgen voor gemakkelijke detectie

- Planten modelleren efficiëntere thermische koelingsmethode

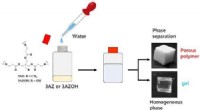
- Gewoon water toevoegen:een eenvoudige methode om veelzijdige poreuze polymeren te verkrijgen
 Nieuwe ontdekking van hoe koolstof wordt opgeslagen in de Zuidelijke Oceaan
Nieuwe ontdekking van hoe koolstof wordt opgeslagen in de Zuidelijke Oceaan  Klimaatbesprekingen:Kent u uw AOSIS van ALBA?
Klimaatbesprekingen:Kent u uw AOSIS van ALBA?  Zorgt omgevingsstress voor migratie?
Zorgt omgevingsstress voor migratie?  Doe Maar, dompel je mobiele telefoon onder in zout water:barrièrefilms door afzetting van atoomlagen
Doe Maar, dompel je mobiele telefoon onder in zout water:barrièrefilms door afzetting van atoomlagen Onderzoek naar zeeslakken helpt het debat te verhelderen over hoe we naar grote evolutionaire transities moeten kijken
Onderzoek naar zeeslakken helpt het debat te verhelderen over hoe we naar grote evolutionaire transities moeten kijken  We kunnen de definitieve schoolcijfers in jaar 11 voorspellen. Het is tijd om stressvolle examens te vervangen door zinvoller onderwijs
We kunnen de definitieve schoolcijfers in jaar 11 voorspellen. Het is tijd om stressvolle examens te vervangen door zinvoller onderwijs  Het voorspellen van de intensiteit van een orkaan kan moeilijk zijn
Het voorspellen van de intensiteit van een orkaan kan moeilijk zijn Dit gebeurt er als gelaagde materialen tot het uiterste worden geduwd
Dit gebeurt er als gelaagde materialen tot het uiterste worden geduwd
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

