
Wetenschap
Waarom is 4 methylpyridine eenvoudiger?
Basis inzicht in Basis
* elektronendonatie: Basisiteit in organische verbindingen heeft vaak betrekking op hoe gemakkelijk een molecuul een elektronenpaar kan doneren. Hoe gemakkelijker een compound is, kan zijn enige elektronen doneren, hoe eenvoudiger het is.
* Pyridine's stikstof: Pyridine heeft een stikstofatoom met een eenzaam paar elektronen. Dit enige paar is beschikbaar voor binding met een proton (H+) om een pyridiniumion te vormen, waardoor pyridine een basis is.
Waarom 4-methylpyridine eenvoudiger is
* inductief effect: De methylgroep (CH3) bevestigd aan de pyridinring in 4-methylpyridine is een elektronen-donerende groep. Dit betekent dat het de elektronendichtheid naar de ring duwt, inclusief het stikstofatoom.
* elektronendichtheid bij stikstof: Verhoogde elektronendichtheid op het stikstofatoom maakt zijn enige paar meer beschikbaar voor donatie. Dit maakt 4-methylpyridine een sterkere basis dan pyridine zelf.
Samenvattend:
De methylgroep in 4-methylpyridine verhoogt de elektronendichtheid op het stikstofatoom, waardoor het gemakkelijker zijn enige paar doneert en dus meer eenvoudig.
 Het dodental door de overstromingen in Kenia loopt op tot 188, omdat de zware regenval aanhoudt
Het dodental door de overstromingen in Kenia loopt op tot 188, omdat de zware regenval aanhoudt  De helft van de wereldbevolking wordt blootgesteld aan toenemende luchtvervuiling, studie toont
De helft van de wereldbevolking wordt blootgesteld aan toenemende luchtvervuiling, studie toont Is het door de wind geblazen slib dat het landschap deken?
Is het door de wind geblazen slib dat het landschap deken?  Onderzoekers vinden zeebodemvalleien onder West-Antarctische gletsjers
Onderzoekers vinden zeebodemvalleien onder West-Antarctische gletsjers Oceanen warmen nog sneller op dan eerder werd gedacht
Oceanen warmen nog sneller op dan eerder werd gedacht
Hoofdlijnen
- Welk proces reproduceren bacteriën seksueel?
- Waarom kun je de basisserse sequentie van één standaard in een molecuul -DNA voorspellen als je andere standaard weet?
- Anti-insuline-eiwit gekoppeld aan levensduur en voortplanting bij mieren
- Hoe is Euglena vergelijkbaar met een plantencel?
- Vooruitgang op weg naar een biologische brandstofcel?
- Project om het publiek toegang te geven tot 3D-modellen met hoge resolutie van de anatomie van gewervelde dieren
- Generaal Sherman slaagt voor de gezondheidscontrole, maar 's werelds grootste bomen worden geconfronteerd met toenemende klimaatbedreigingen
- Wat doet ethanol in een DNA-extractie?
- Bestaat zaad uit moleculen?
- Onderzoeksgroep gebruikt supercomputing om zich te richten op de meest veelbelovende kandidaat-geneesmiddelen uit een enorm aantal mogelijkheden
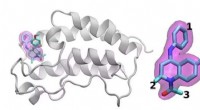
- Wetenschappers onthullen structuur van aminozuurtransporter die betrokken is bij kanker

- Onderzoekers ontwikkelen een manier om corrosie door ruwe olie beter te voorspellen

- Franse wetenschappers beweren metallische waterstof te hebben gemaakt
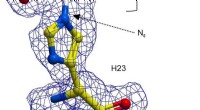
- Chemici tonen aan dat het katalytische bereik van enzymen kan worden vergroot
 Wat is het woordvergelijking voor koper en chloor?
Wat is het woordvergelijking voor koper en chloor?  NASA-NOAA-satelliet biedt een nachtelijk beeld van nieuwe Atlantische tropische depressie
NASA-NOAA-satelliet biedt een nachtelijk beeld van nieuwe Atlantische tropische depressie Nieuw inzicht in de vorming van kristallen kan materialen, gezondheid en fundamenteel wetenschappelijk onderzoek bevorderen
Nieuw inzicht in de vorming van kristallen kan materialen, gezondheid en fundamenteel wetenschappelijk onderzoek bevorderen  Laatste versie van Global Aridity Index and Potential Evapotranspiration Database vrijgegeven
Laatste versie van Global Aridity Index and Potential Evapotranspiration Database vrijgegeven Hoeveel steenkool zou er verbrand worden om de potentiële energie in één pellet uranium te evenaren?
Hoeveel steenkool zou er verbrand worden om de potentiële energie in één pellet uranium te evenaren?  Hoe wordt het nummer 160000000 weergegeven in wetenschappelijke notatie?
Hoe wordt het nummer 160000000 weergegeven in wetenschappelijke notatie?  Welke grens kan een geul worden gevonden?
Welke grens kan een geul worden gevonden?  Hoeveel mijl zijn er rond de omtrek van 52 hectare?
Hoeveel mijl zijn er rond de omtrek van 52 hectare?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

