
Wetenschap
Wat doen mobiele elektronen in metalen?
* elektrische geleidbaarheid: Deze elektronen kunnen gemakkelijk door de structuur van het metaal bewegen, waardoor de stroom van elektrische stroom mogelijk is. Wanneer een elektrisch veld wordt aangebracht, drijven de elektronen in een richting tegenover het veld, met de lading.
* Thermische geleidbaarheid: De mobiele elektronen kunnen ook warmte -energie dragen. Wanneer een deel van het metaal wordt verwarmd, krijgen de elektronen in die regio energie en gaan ze naar koelere gebieden, waardoor warmte -energie wordt overgedragen.
* Metallic Luster: De mobiele elektronen kunnen licht absorberen en opnieuw uitbrengen, waardoor metalen hun karakteristieke glans krijgen.
* kneedbaarheid en ductiliteit: Door de mobiele elektronen kan metaalatomen langs elkaar glijden zonder de metalen binding te verbreken. Daarom kunnen metalen worden gehamerd in dunne vellen (kneedbaarheid) of in draden (ductiliteit) worden getrokken.
Hoe het werkt:
In een metaal zijn de buitenste elektronen van de atomen losjes gebonden en kunnen vrij door het kristalrooster bewegen. Deze "zee" van mobiele elektronen maakt metalen anders dan andere materialen.
Het "elektronzeemodel":
Een vereenvoudigd model om dit concept te begrijpen is het "elektronenzeemodel". Stel je een metaal voor als een rooster van positieve ionen omringd door een "zee" van gedelokaliseerde elektronen. Deze elektronen zijn niet gebonden aan een bepaald atoom, maar zijn vrij om door de hele structuur te bewegen.
Belangrijke punten om te onthouden:
* De mobiele elektronen zijn verantwoordelijk voor veel van de bepalende eigenschappen van metalen.
* Ze zijn gedelocaliseerd en vrij om door het hele metalen rooster te bewegen.
* Het "elektronenzeemodel" is een nuttige visualisatie van dit concept.
 Wetenschappelijke verklaring van Tyfoons
Wetenschappelijke verklaring van Tyfoons  Om als levend te worden beschouwd, moet een object wat hebben?
Om als levend te worden beschouwd, moet een object wat hebben?  Wat is een stormvloedkering en waarom is het zo gevaarlijk?
Wat is een stormvloedkering en waarom is het zo gevaarlijk? Wat zorgt ervoor dat zoetwaterplanten zowel in het water als op het land kunnen leven?
Wat zorgt ervoor dat zoetwaterplanten zowel in het water als op het land kunnen leven?  NASA vindt krachtige stormen rond het centrum van Tropical Storm Cristinas
NASA vindt krachtige stormen rond het centrum van Tropical Storm Cristinas
Hoofdlijnen
- Hoe wordt het proces genoemd wanneer een cel zich in 2 delen verdeelt, dan 4 delen?
- In welke cellen vindt de ademhaling plaats?
- Wat voor soort twee materialen gebruikt het blad om suiker te produceren?
- Hoe een dinosaurus te wegen
- Wat betekent scheiden in de menselijke biologie?
- Hoeveel soorten weefsel maken onze hersenen?
- Wat is het deel van plantencel dat instructie bevat voor Called?
- Biologen werpen licht op hoe cellen hulpbronnen verplaatsen
- Welke wetenschapper werd gecrediteerd voor gedetailleerde studie van de menselijke anatomie?
- Tikken geheimen van Aussie spiders unieke zijde

- Nieuwe aanpak kan leiden tot ontworpen kunststoffen met specifieke eigenschappen

- Opneembare medische hulpmiddelen kunnen met licht worden afgebroken

- Nieuwsgierige in elkaar grijpende moleculen vertonen een dubbele respons
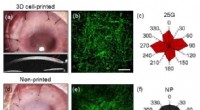
- 3D-geprinte kunstmatige hoornvliezen vergelijkbaar met menselijke hoornvliezen
 Afsterven van koraal voorspeld als mariene hittegolf Hawaii overspoelt
Afsterven van koraal voorspeld als mariene hittegolf Hawaii overspoelt Waarom is er minder zuurstof op de top van een berg?
Waarom is er minder zuurstof op de top van een berg?  Noordoostelijke boeren staan voor nieuwe uitdagingen door ernstige droogte
Noordoostelijke boeren staan voor nieuwe uitdagingen door ernstige droogte Wat is de relatie tussen de relativiteitstheorie en zwarte gaten?
Wat is de relatie tussen de relativiteitstheorie en zwarte gaten?  Verborgen mysteries liggen op de loer in de fossielenschatkamer van Kenia
Verborgen mysteries liggen op de loer in de fossielenschatkamer van Kenia Een ventilator op batterijen maken
Een ventilator op batterijen maken Op maat gemaakt meta-raster van nanodeeltjes die de prestaties van lichtemitterende diodes verbeteren
Op maat gemaakt meta-raster van nanodeeltjes die de prestaties van lichtemitterende diodes verbeteren Hoe vinden de volle maan en geen nachten plaats?
Hoe vinden de volle maan en geen nachten plaats?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

