
Wetenschap
Welke elementen zullen optreden als diatomaire moleculen en kunnen geen individuele atomen bestaan?
De zeven elementen die optreden als diatomaire moleculen onder standaardomstandigheden zijn:
* waterstof (h 2 )
* stikstof (n 2 )
* zuurstof (o 2 )
* fluor (f 2 )
* chloor (Cl 2 )
* bromine (Br 2 )
* jodium (i 2 )
Deze elementen zijn stabieler als diatomaire moleculen vanwege de sterke covalente bindingen die ze met zichzelf vormen. Deze bindingen worden gevormd door elektronen te delen tussen twee atomen van hetzelfde element, wat resulteert in een stabielere elektronenconfiguratie.
Het is belangrijk om te onthouden dat deze elementen niet de * alleen * elementen zijn die diatomaire moleculen kunnen vormen, alleen degenen die vaak worden aangetroffen als diatomaire moleculen in de natuur.
 Biobased compound biedt een groener alternatief voor koolstofvezel
Biobased compound biedt een groener alternatief voor koolstofvezel Video:Waarom ze geen klasse B ahornsiroop meer maken
Video:Waarom ze geen klasse B ahornsiroop meer maken Waarom reageert magnesiummetaal met een kopersulfaatoplossing terwijl het geen oplossing is?
Waarom reageert magnesiummetaal met een kopersulfaatoplossing terwijl het geen oplossing is?  Inpluggen om milieuvriendelijke bioplastics te produceren
Inpluggen om milieuvriendelijke bioplastics te produceren Hoe weet ik of mijn katalysator defect is?
Hoe weet ik of mijn katalysator defect is?
 Wat betekent wetenschappelijke verdienste?
Wat betekent wetenschappelijke verdienste?  Op welke drie manieren beïnvloedt de geosfeer mensen dagelijks?
Op welke drie manieren beïnvloedt de geosfeer mensen dagelijks?  Nieuw onderzoek gebruikt satellieten om het einde van vulkaanuitbarstingen te voorspellen
Nieuw onderzoek gebruikt satellieten om het einde van vulkaanuitbarstingen te voorspellen Antarctische ijsplaten kwetsbaar voor plotselinge door smeltwater veroorzaakte breuken, zegt studie
Antarctische ijsplaten kwetsbaar voor plotselinge door smeltwater veroorzaakte breuken, zegt studie Wie beschreef evolutie door natuurlijke selectie?
Wie beschreef evolutie door natuurlijke selectie?
Hoofdlijnen
- De vier eigenschappen van spiercellen
- Hoe bevers nat blijven tijdens droogte in het VK
- Wat is een vorm van endocytose waarbij transportvloeistofdruppeltjes of kleine deeltjes betrokken zijn?
- Wat is moleculaire gastronomie?
- Hoe worden enzymen beïnvloed door de omgeving?
- Verschillen langlevende gewassen van jaarlijkse gewassen in hun genetische reactie op menselijke domesticatie?
- Waarom is membraantransport van vitaal belang voor normale celfuncties?
- Wat moet er waar zijn dat een hypothese door wetenschapper algemeen wordt geaccepteerd?
- Hoe een bescheiden paddenstoel bossen kan redden en klimaatverandering kan bestrijden
- 4D-printen van omkeerbare vormveranderende materialen met op licht gebaseerde grijswaardenpatronen
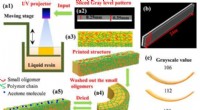
- Ontwikkeling van een nieuw, goedkoop apparaat voor de productie van galliumnitride (GaN) kristallen

- Nieuw inzicht in het trainen van zeer reactieve chemische verbindingen

- Wetenschappers ID-enzym voor het maken van belangrijke industriële chemicaliën in planten
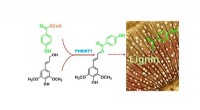
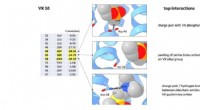
- Team maakt allereerste VX-neurotoxinedetector
 Online mythbusters vechten tegen de stroom van nepnieuws in India
Online mythbusters vechten tegen de stroom van nepnieuws in India De verbazingwekkende manier waarop babyvogels vanuit hun eieren communiceren
De verbazingwekkende manier waarop babyvogels vanuit hun eieren communiceren Hoe het percentage van een ander getal te berekenen
Hoe het percentage van een ander getal te berekenen De verschillen tussen dieren en insecten
De verschillen tussen dieren en insecten Wat is de chemische oplossing die wordt gebruikt om kleuren te verzachten bij de ontwikkeling van foto?
Wat is de chemische oplossing die wordt gebruikt om kleuren te verzachten bij de ontwikkeling van foto?  Wat zijn enthousiaste organen?
Wat zijn enthousiaste organen?  Welke kleur is het neerslag van sulfaationen?
Welke kleur is het neerslag van sulfaationen?  Luchtthermometer om arctische temperaturen te meten
Luchtthermometer om arctische temperaturen te meten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

