
Wetenschap
Met welke andere elementen heeft fluor de neiging om zich te verbinden?
metalen:
* Alkali -metalen (groep 1): Fluor vormt gemakkelijk ionische verbindingen met alkali -metalen, zoals natriumfluoride (NAF), kaliumfluoride (KF) en lithiumfluoride (LIF).
* alkalische aardmetalen (groep 2): Vergelijkbaar met alkali -metalen vormt fluor -ionische verbindingen met alkalische aardmetalen zoals calciumfluoride (CAF2) en magnesiumfluoride (MGF2).
* overgangsmetalen: Fluor kan ook ionische verbindingen vormen met overgangsmetalen, zoals ijzer (III) fluoride (FEF3) en koper (II) fluoride (CUF2).
Niet -metalen:
* waterstof: Fluor vormt een covalente binding met waterstof om waterstoffluoride (HF) te produceren, een zeer sterk zuur.
* halogenen: Fluorine kan reageren met andere halogenen, zoals chloor (CL) en broom (BR), om interhalogene verbindingen te vormen, zoals chloormonofluoride (CLF) en broommonofluoride (BRF).
* zuurstof: Fluor kan reageren met zuurstof om zuurstoffluoriden te vormen, zoals zuurstofdifluoride (OF2) en dioxygen difluoride (O2F2).
* stikstof: Fluor reageert met stikstof om stikstoftrifluoride (NF3) te vormen, een kleurloos en geurloos gas.
* koolstof: Fluor kan reageren met koolstof om koolstof tetrafluoride (CF4) te vormen, een zeer stabiel en inert gas.
Andere:
* Nobele gassen: Hoewel fluor over het algemeen niet -reactief is met edelgassen, kan het verbindingen vormen met Xenon, zoals Xenon Difluoride (XEF2) en Xenon Tetrafluoride (XEF4).
Belangrijke opmerking: De reactiviteit van fluor is extreem hoog, waardoor het zeer gevaarlijk is om te hanteren. Het is belangrijk om te onthouden dat deze reacties vaak gespecialiseerde apparatuur en omstandigheden vereisen vanwege de corrosieve en reactieve aard van fluor.
 Heeft verschillende vloeistoffen invloed op het tijdstip van oplossen?
Heeft verschillende vloeistoffen invloed op het tijdstip van oplossen?  Is kwik een metaal of metalloïde?
Is kwik een metaal of metalloïde?  Contrafeiten gebruiken om voorspellingen over de veiligheid van geneesmiddelen te verifiëren
Contrafeiten gebruiken om voorspellingen over de veiligheid van geneesmiddelen te verifiëren Cr NH3 6 No3 3 heeft hoeveel elementen en atomen?
Cr NH3 6 No3 3 heeft hoeveel elementen en atomen?  In een nucleaire fusiereactie is de massa producten?
In een nucleaire fusiereactie is de massa producten?
 Aandacht voor gezondheid bij het overstappen op schonere elektriciteit
Aandacht voor gezondheid bij het overstappen op schonere elektriciteit Moerassen zijn unieke records van de geschiedenis - hier is waarom
Moerassen zijn unieke records van de geschiedenis - hier is waarom Hoe reageren vogels op sesamzaad?
Hoe reageren vogels op sesamzaad?  Klimaatverandering heeft de wereldwijde economische ongelijkheid verergerd
Klimaatverandering heeft de wereldwijde economische ongelijkheid verergerd Een stap opzij, interne getijden:supercomputermodellering verbetert de nauwkeurigheid van de hoogtemeting van satellieten
Een stap opzij, interne getijden:supercomputermodellering verbetert de nauwkeurigheid van de hoogtemeting van satellieten
Hoofdlijnen
- Onderzoeken hoe bryofyten zich aanpassen zonder gibberelline
- Hoeveel manieren waarop wetenschap nuttig is voor mensen?
- Welk eindproduct is van het grootste voordeel voor het organisme waarin ademhaling optreedt?
- Wat is een verandering in de DNA-code?
- Welke celtypen blijven in niet-verdeeld stadium en voltooien het mitoseproces niet?
- Wat is een weekdier?
- Wat gebeurt er als je een lijk ontdooit?
- Druk jezelf uit:hoe zygoten ingeprent genen uitzoeken
- Waarom gebruiken wetenschappers SI?
- Ontwikkeld materiaal dat tegelijkertijd warmte-isolerend en warmtegeleidend is

- Kathodemateriaal gemaakt van organische moleculen verbetert de groene eigenschappen van oplaadbare batterijen
- Nieuw supramoleculaire plastic dat afbreekbaar en zeer recyclebaar is

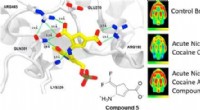
- Een verbeterd medicijn tegen verslaving
- Beeldvorming van structurele veranderingen in katalysatoren tijdens reactieomstandigheden

 Waarom gebruikt de meteoroloog weersymbolen?
Waarom gebruikt de meteoroloog weersymbolen?  Waarom denk je dat kolenwinning een duurzame energiebron is?
Waarom denk je dat kolenwinning een duurzame energiebron is?  1,2 cm in hoeveel centimeter?
1,2 cm in hoeveel centimeter?  Nieuwe glasvezelsonde brengt endoscopische diagnose van kanker dichter bij de kliniek
Nieuwe glasvezelsonde brengt endoscopische diagnose van kanker dichter bij de kliniek Nieuwe studie biedt oplossing voor engineering van cellulaire materialen
Nieuwe studie biedt oplossing voor engineering van cellulaire materialen Hoe doen ze het? Er worden voorspellingen gedaan over het dieptepunt van het zee-ijs in de Noordpool
Hoe doen ze het? Er worden voorspellingen gedaan over het dieptepunt van het zee-ijs in de Noordpool  Fruitvliegjesplaag ontmoet zijn evolutionaire match in sluipwesp
Fruitvliegjesplaag ontmoet zijn evolutionaire match in sluipwesp  Hoe communiceerde Apollo11 met mensen op aarde?
Hoe communiceerde Apollo11 met mensen op aarde?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

