
Wetenschap
Hoe beïnvloedt de snelheid van moleculen de luchtteperatuur?
* Temperatuur is een maat voor de gemiddelde kinetische energie van moleculen. Kinetische energie is de energie van beweging. Hoe sneller de moleculen bewegen, hoe meer kinetische energie ze bezitten.
* snellere moleculen =hogere temperatuur. Wanneer moleculen sneller bewegen, botsen ze vaker en met een grotere kracht. Deze verhoogde botsingssnelheid en kracht vertaalt zich in een hogere waargenomen temperatuur.
* langzamere moleculen =lagere temperatuur. Wanneer moleculen langzamer bewegen, botsen ze minder vaak en met minder kracht. Dit resulteert in een lagere waargenomen temperatuur.
Hier is een eenvoudige analogie: Stel je een kamer vol mensen voor. Als iedereen stilstaat, voelt de kamer kalm en stil. Dat is als langzaam bewegende moleculen, wat resulteert in een lage temperatuur. Als iedereen begint rond te rennen en tegen elkaar te botsen, voelt de kamer chaotisch en energiek. Dat is als snel bewegende moleculen, wat resulteert in een hoge temperatuur.
Belangrijke punten om te onthouden:
* Gemiddelde snelheid is de sleutel: Temperatuur weerspiegelt de gemiddelde kinetische energie van alle moleculen in een stof. Zelfs als sommige moleculen langzaam bewegen, bewegen anderen misschien heel snel, maar het is het gemiddelde dat ertoe doet.
* Verschillende stoffen, verschillende snelheden: Dezelfde temperatuur betekent niet dezelfde moleculaire snelheid voor verschillende stoffen. Watermoleculen bewegen bijvoorbeeld sneller bij een gegeven temperatuur dan luchtmoleculen.
* Warmte en temperatuur zijn gerelateerd: Warmte is de totale energie van alle moleculen in een stof, terwijl temperatuur de gemiddelde energie per molecuul is.
Dus, in wezen, hoe sneller de moleculen bewegen, hoe hoger de luchttemperatuur.
 Nieuwe ontdekkingen en inzichten in de glasovergang
Nieuwe ontdekkingen en inzichten in de glasovergang Moleculaire chaperonne-interacties gevisualiseerd door middel van röntgenstructuuranalyse
Moleculaire chaperonne-interacties gevisualiseerd door middel van röntgenstructuuranalyse Wat gebeurt er meestal met de elektronenconfiguratie van een atoom wanneer deze zich vormt?
Wat gebeurt er meestal met de elektronenconfiguratie van een atoom wanneer deze zich vormt?  Nieuw upcycling-systeem voor commerciële polyesters
Nieuw upcycling-systeem voor commerciële polyesters Hoe de topologie van een poreus materiaal de fasescheiding van binaire mengsels beïnvloedt
Hoe de topologie van een poreus materiaal de fasescheiding van binaire mengsels beïnvloedt
 Hoe groeien planten in verschillende omgevingen?
Hoe groeien planten in verschillende omgevingen?  7 lessen die Canada uit de Tweede Wereldoorlog zou moeten gebruiken om de klimaatnoodsituatie te bestrijden
7 lessen die Canada uit de Tweede Wereldoorlog zou moeten gebruiken om de klimaatnoodsituatie te bestrijden Wat is de natuurtheorie?
Wat is de natuurtheorie?  De cryosfeer van de aarde krimpt met 87, 000 vierkante kilometer per jaar
De cryosfeer van de aarde krimpt met 87, 000 vierkante kilometer per jaar Major orkaan Juliettes opkomend oog gespot in NASA-satellietbeelden
Major orkaan Juliettes opkomend oog gespot in NASA-satellietbeelden
Hoofdlijnen
- Wat eten we? Genetisch gemanipuleerde zalm goedgekeurd door de FDA
- Is ademhaling de exacte omkering van biochemische paden fotosynthese?
- Hoe verouderende klokken tikken:nieuwe studie wijst op stochastische veranderingen in cellen
- Welke voordelen heeft biologische landbouw voor de honingbijen?
- Hoe verschijnen wetenschappelijke namen in druk?
- Hoe bloedcellen vervormen en herstellen wanneer ze door kleine kanaaltjes reizen
- Waarom is ATP nodig om het lichaam normaal te laten functioneren?
- Chemische stoffen gebruikt in de forensische wetenschap
- Hoe werkt het cytoplasma eruit?
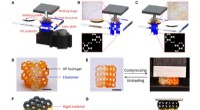
- 3D-printen van zeer rekbare hydrogel met diverse UV-uithardbare polymeren
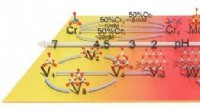
- Karakteriseringsstrategie helpt bij het scheiden van metaal met een hoge zuiverheid
- Dubbele emulsies in magere melk met minimale food-grade emulgatoren voor magere kaas

- Klimaatbescherming:CO2 omgezet in methanol
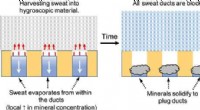
- Het zweet tegen zichzelf keren met een metaalvrije anti-transpirant
 Hoe schatten consumenten een goede tijd in?
Hoe schatten consumenten een goede tijd in?  Hoe worden elementen gevormd in sterren?
Hoe worden elementen gevormd in sterren?  Kan ik die chemicaliën mengen? Daar is een app voor!
Kan ik die chemicaliën mengen? Daar is een app voor! Wat is de partiële zuurstofdruk in een container van 2 liter?
Wat is de partiële zuurstofdruk in een container van 2 liter?  Hoe zou u het aantal protonen of elektronen in een atoom vinden?
Hoe zou u het aantal protonen of elektronen in een atoom vinden?  Nachtelijke satellietbeelden van NASA-NOAA onthullen de ontwikkeling van tropische storm Josephine
Nachtelijke satellietbeelden van NASA-NOAA onthullen de ontwikkeling van tropische storm Josephine Microstaafjes gemaakt van lanthanoïde organische raamwerken fungeren als optische golfgeleiders op microschaal
Microstaafjes gemaakt van lanthanoïde organische raamwerken fungeren als optische golfgeleiders op microschaal Team vindt stabiel RNA-nano-scaffold in viruskern
Team vindt stabiel RNA-nano-scaffold in viruskern
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

