
Wetenschap
Waarom lossen dingen op?
1. Intermoleculaire krachten:
* Aantrekking tussen opgeloste en oplosmiddelmoleculen: De opgeloste moleculen moeten worden aangetrokken door de oplosmiddelmoleculen. Deze attracties kunnen te wijten zijn aan:
* waterstofbinding: Het sterkste type aantrekkingskracht, vaak gevonden tussen watermoleculen en moleculen met polaire groepen zoals alcoholen en suikers.
* Dipole-dipole interacties: Zwakkere aantrekkingskracht tussen polaire moleculen, zoals ethanol en aceton.
* Dispersietroepen in Londen: Zwakste type aantrekkingskracht, gevonden tussen alle moleculen, maar sterker voor grotere moleculen.
* Het overwinnen van opgeloste interacties van opgeloste stof: Voor een opgeloste oplossing moeten de aantrekkelijke krachten tussen zijn eigen moleculen worden overwonnen. Dit is eenvoudiger als de aanleg van de opgeloste oplosmiddelen sterker is.
2. Entropie:
* verhoogde willekeur: Oplost leidt vaak tot een toename van de algehele willekeur van het systeem (entropie). Dit komt omdat de opgeloste moleculen meer verspreid zijn in het oplosmiddel, wat leidt tot een meer ongeordende toestand.
3. Enthalpy:
* Energie verandert: Oplost kan exotherme zijn (warmte vrijgeven) of endotherm (absorberende warmte).
* Exotherme oplossing: De aantrekkelijke krachten tussen opgeloste stof en oplosmiddel zijn sterker dan die binnen de opgeloste stof en het oplosmiddel zelf, wat leidt tot een afgifte van energie.
* Endothermische oplossing: De aantrekkelijke krachten binnen de opgeloste stof en oplosmiddel zijn sterker, waardoor energie -input moet worden overwonnen.
De "like lost like" -regel:
Een algemene vuistregel is dat polaire opgeloste opgeloste stoffen goed oplossen in polaire oplosmiddelen en niet -polaire opgeloste stoffen oplossen goed in niet -polaire oplosmiddelen. Dit komt omdat de krachten tussenachtige moleculen over het algemeen sterker zijn dan die tussen in tegenstelling tot moleculen.
Voorbeeld:
* zout (NaCl) oplossen in water:
* Water is polair vanwege de ongelijke verdeling van elektronen, waardoor een gedeeltelijke positieve lading ontstaat op de waterstofatomen en een gedeeltelijke negatieve lading op het zuurstofatoom.
* Zout is ook ionisch, met positieve natriumionen (Na+) en negatieve chloride-ionen (Cl-) samengehouden door elektrostatische krachten.
* De watermoleculen omringen de ionen, met de gedeeltelijke negatieve ladingen van de zuurstofatomen aangetrokken tot de positieve natriumionen en de gedeeltelijke positieve ladingen van de waterstofatomen aangetrokken tot de negatieve chloride -ionen.
* Deze attractie overwint de krachten die de zoutionen bij elkaar houden, waardoor het zout oplost.
Samenvattend:
Oplost treedt op wanneer de aantrekkelijke krachten tussen de opgeloste stof en oplosmiddelmoleculen sterk genoeg zijn om de krachten te overwinnen die de opgeloste moleculen bij elkaar houden, terwijl ook leidt tot een toename van de willekeur (entropie) van het systeem. Dit proces kan exotherme of endotherm zijn, afhankelijk van de relatieve sterke punten van de betrokken interacties.
 Word wakker en ruik de koffie:onderzoek toont aan dat bevriezing van bonen het aroma kan behouden
Word wakker en ruik de koffie:onderzoek toont aan dat bevriezing van bonen het aroma kan behouden Welke eigenschappen van een verbinding zouden je doen verwachten dat deze ionische bindingen bevat?
Welke eigenschappen van een verbinding zouden je doen verwachten dat deze ionische bindingen bevat?  Waarom sommige groenen bruin worden in historische schilderijen
Waarom sommige groenen bruin worden in historische schilderijen Afvangen en omzetten van kooldioxide in een bruikbaar product
Afvangen en omzetten van kooldioxide in een bruikbaar product Hoeveel mol zit er ongeveer in 300 gram zwavel?
Hoeveel mol zit er ongeveer in 300 gram zwavel?
 Iraakse Koerdische boeren vechten tegen droogte terwijl Lake Dukan zich terugtrekt
Iraakse Koerdische boeren vechten tegen droogte terwijl Lake Dukan zich terugtrekt Globale oceanische dode zones bleven 50 jaar bestaan, 000 jaar na het uitsterven van het einde van het Trias
Globale oceanische dode zones bleven 50 jaar bestaan, 000 jaar na het uitsterven van het einde van het Trias NASA-infraroodbeeld toont krachtig centrum van tyfoon Wutip
NASA-infraroodbeeld toont krachtig centrum van tyfoon Wutip Wat is het doel van basiswetenschap.?
Wat is het doel van basiswetenschap.?  Hoe Tree of Life verklaart zowel eenheid als het diversiteitsleven?
Hoe Tree of Life verklaart zowel eenheid als het diversiteitsleven?
Hoofdlijnen
- Hoe werkt een rebreather?
- Hoe een ‘evolutionaire speeltuin’ plantengenen bij elkaar brengt
- Wat zijn drie verschillen tussen oomycetes en schimmels?
- Wat zijn cocci die zich voordoen in clusters of groepen die worden genoemd?
- Wat is het primaire niveau van een eiwitstructuur?
- Biologen onderzoeken wat er gebeurt als eigenschappen tussen takken van de boom springen
- Is het waar dat de celwand binnen het membraan ligt?
- Is lachen besmettelijk?
- Waarom gedijen een gewasplant zoals aardappelen wanneer hun enige waterbron regenwater is?
- Deeltjes van alledaagse muurverven kunnen levende organismen schaden, maar een nieuw membraan vertoont hoge filtereffecten

- Het stimuleren van chemische reacties in vaste toestand
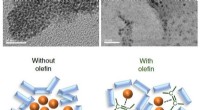
- Unieke ferro-elektrische microstructuur voor het eerst onthuld

- Interdisciplinaire interacties inspireren nieuwe ontdekkingen

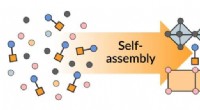
- Een eenvoudige manier om complexe halfgeleiders zichzelf te laten assembleren
 Veranderingen in het bladerdak vergemakkelijkten de evolutie van het allereerste glijdende reptiel, suggereert nieuw onderzoek
Veranderingen in het bladerdak vergemakkelijkten de evolutie van het allereerste glijdende reptiel, suggereert nieuw onderzoek Bemanningen maken 250 schoon, 000 pond oliepuin van de kusten van Orange County als stranden heropenen
Bemanningen maken 250 schoon, 000 pond oliepuin van de kusten van Orange County als stranden heropenen Hoe darmcellen zichzelf vernieuwen
Hoe darmcellen zichzelf vernieuwen  Nieuw nanodeeltje onthult de effectiviteit van kankerbehandelingen in realtime
Nieuw nanodeeltje onthult de effectiviteit van kankerbehandelingen in realtime De eerste zachte ringoscillator laat zachte robots rollen, golven, soort, metervloeistoffen, en slikken
De eerste zachte ringoscillator laat zachte robots rollen, golven, soort, metervloeistoffen, en slikken Wat is een kloof in de geografie?
Wat is een kloof in de geografie?  Voor lithiummetaal, kleiner is sterker
Voor lithiummetaal, kleiner is sterker Eiwitketens die zichzelf tot spiraalvormige vlechten vormen
Eiwitketens die zichzelf tot spiraalvormige vlechten vormen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

