
Wetenschap
Hoe verschilt een gepolariseerd anion van een ongepolariseerd anion?
Hier is hoe we het verschil kunnen interpreteren:
gepolariseerd anion:
* Definitie: Een anion met een ongelijke verdeling van elektronendichtheid, wat resulteert in een tijdelijk of permanent dipoolmoment.
* Oorzaken van polarisatie:
* Elektronegativiteitsverschil: Als een anion wordt gebonden aan een zeer elektronegatief atoom (zoals zuurstof), zullen de elektronen in de binding worden getrokken naar het elektronegatieve atoom, waardoor een gedeeltelijke negatieve lading op dat atoom en een gedeeltelijke positieve lading op het anion ontstaat.
* Groot formaat en hoge ladingsdichtheid: Anionen met grote omvang en hoge ladingsdichtheid (zoals jodide, i-) zijn gemakkelijker gepolariseerd vanwege de grotere verdeling van hun elektronenwolk.
* gevolgen van polarisatie:
* Verhoogde reactiviteit: Gepolariseerde anionen zijn reactiever omdat de gedeeltelijke positieve lading nucleofielen of elektrofielen kan aantrekken.
* gewijzigde bindhoeken en vormen: Polarisatie kan de bindingshoeken en de algehele vorm van een molecuul dat het gepolariseerde anion bevat beïnvloeden.
ongepolariseerd anion:
* Definitie: Een anion met een gelijkmatige verdeling van elektronendichtheid, zonder een aanzienlijk dipoolmoment.
* Oorzaken van niet -folarisatie:
* Klein formaat en lage ladingsdichtheid: Anionen met klein formaat en lage ladingsdichtheid (zoals fluoride, F-) zijn minder gemakkelijk gepolariseerd.
* binding met minder elektronegatieve atomen: Anionen verbonden aan minder elektronegatieve atomen zullen minder elektronenonttrekking ervaren en blijven daarom minder gepolariseerd.
* gevolgen van niet -folarisatie:
* Lagere reactiviteit: Niet -gefolariseerde anionen zijn over het algemeen minder reactief in vergelijking met hun gepolariseerde tegenhangers.
* Minder invloed op bindingshoeken: Het ontbreken van een aanzienlijk dipoolmoment betekent dat ze een minimale impact hebben op de algehele moleculaire vorm.
Voorbeelden:
* gepolariseerd: Het anion in een carbonylgroep (C =O) is gepolariseerd vanwege de hoge elektronegativiteit van zuurstof.
* ongepolariseerd: Het fluoride-anion (F-) is relatief ongepolariseerd vanwege zijn kleine omvang en lage ladingsdichtheid.
Samenvattend:
Het verschil tussen een gepolariseerd anion en een ongepolariseerd anion ligt in de verdeling van elektronendichtheid. Polarisatie leidt tot een tijdelijk of permanent dipoolmoment, dat van invloed is op de reactiviteit, vorm en interacties van het anion met andere moleculen. Niet -gefolariseerde anionen missen deze ongelijke verdeling en zijn over het algemeen minder reactief en hebben minimale invloed op de moleculaire vorm.
 Hoe worden de snelheden van moleculen in de lucht beïnvloed wanneer deze wordt gecomprimeerd door een bandenpomp?
Hoe worden de snelheden van moleculen in de lucht beïnvloed wanneer deze wordt gecomprimeerd door een bandenpomp?  Hoe maak je een citroenzuurbufferoplossing
Hoe maak je een citroenzuurbufferoplossing Wetenschappers ontcijferen het belangrijkste principe achter de reactie van metallo-enzymen
Wetenschappers ontcijferen het belangrijkste principe achter de reactie van metallo-enzymen Is een nikkel pure substantie?
Is een nikkel pure substantie?  Elektroreductie van koolmonoxide voor de zeer selectieve productie van ethyleen
Elektroreductie van koolmonoxide voor de zeer selectieve productie van ethyleen
 Voordelen en nadelen van bebossing
Voordelen en nadelen van bebossing Nieuwe studiemodellen impact van afkalven op terugtrekking van Thwaites-gletsjer
Nieuwe studiemodellen impact van afkalven op terugtrekking van Thwaites-gletsjer 75-80 procent kans op El Nino in de komende 3 maanden:UN
75-80 procent kans op El Nino in de komende 3 maanden:UN NASA-satellietbeelden tonen windschering die tropische storm Jerry beïnvloedt
NASA-satellietbeelden tonen windschering die tropische storm Jerry beïnvloedt Hoe te bepalen of een inktvis mannelijk of vrouwelijk is?
Hoe te bepalen of een inktvis mannelijk of vrouwelijk is?
Hoofdlijnen
- Wat zijn enkele kenmerken van proteïne?
- Onderzoeksgroep ontdekt de oorsprong van octopussen onmiddellijke modulatie van lichaamskleuring
- Onderzoek onthult hoe cellen zich herbouwen na mitose
- Waarom werken groepen wetenschappers vaak samen en waarom is het belangrijk om objecten volledig te beschrijven?
- Het gebied van een lang bot waar lengtegroei optreedt, is het?
- Pyridine betrokken bij massale sterfte aan schaaldieren
- Wat zijn mitochondria niet gevonden?
- Wat zijn de 2 belangrijkste verschillen tussen dieren- en plantencellen?
- Was deze hyena een verre voorouder van de hedendaagse termietenetende aardwolf?
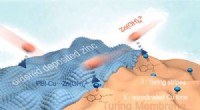
- Turing-membraan om de prestaties van op zink gebaseerde batterijen te verbeteren
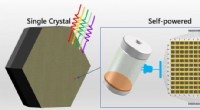
- Multi-inch monokristallijn perovskiet voor zelfaangedreven fotodetectie met geïntegreerde schakelingen gerapporteerd
- Snelle test vindt tekenen van sepsis in een enkele druppel bloed

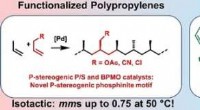
- Katalysatoren voor isotactische polaire polypropylenen
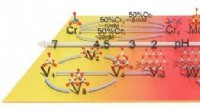
- Karakteriseringsstrategie helpt bij het scheiden van metaal met een hoge zuiverheid
 Onderzoekers vormen ultrasterke koppeling tussen fotonen en atomen
Onderzoekers vormen ultrasterke koppeling tussen fotonen en atomen Omgaan met fouten in het kwantumtijdperk
Omgaan met fouten in het kwantumtijdperk Experimenten met bifluoride-ionen tonen bewijs van hybride bindingen
Experimenten met bifluoride-ionen tonen bewijs van hybride bindingen Nieuwe benadering van mammogrammen kan de betrouwbaarheid verbeteren
Nieuwe benadering van mammogrammen kan de betrouwbaarheid verbeteren Veelgebruikte herbicide in verband met vroeggeboorte
Veelgebruikte herbicide in verband met vroeggeboorte Verder gaan dan plastic:Taragom als groen polymeer
Verder gaan dan plastic:Taragom als groen polymeer  Strafzaak ingediend tegen BMW wegens autobranden in Zuid-Korea
Strafzaak ingediend tegen BMW wegens autobranden in Zuid-Korea NASA stelt zicht op 5 mei lancering van InSight Mars-missie
NASA stelt zicht op 5 mei lancering van InSight Mars-missie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

