
Wetenschap
Wanneer 30 g ijs bij 0c wordt gemengd met 500 g water 45 ° C in een ijzeren container 150 g massa en geroerd tot de all -smelttemperatuur hetzelfde welke eindtemperatuur?
1. Definieer variabelen:
* m_ice: Massa van ijs =30 g
* m_water: Massa water =500 g
* m_iron: Massa ijzeren container =150 g
* t_ice: Initiële temperatuur van ijs =0 ° C
* t_water: Initiële temperatuur van water =45 ° C
* t_final: Eindtemperatuur van het mengsel (wat we willen vinden)
* l_fusion: Latente fusie van ijs =334 J/g
* c_water: Specifieke warmtecapaciteit van water =4,18 J/(G ° C)
* c_iron: Specifieke warmtecapaciteit van ijzer =0,45 J/(G ° C)
2. Stel de warmtebalansvergelijking in:
De totale hitte die het ijs wordt gewonnen (smelten en opwarming) moet gelijk zijn aan de totale warmte die verloren wordt door het water en de ijzeren container terwijl ze afkoelen:
* Warmte gewonnen door ijs =warmte verloren door water + warmte verloren door ijzer
3. Breek de warmte -termen af:
* Warmte verworven door ijs:
* smelten: m_ice * l_fusion
* opwarming: m_ice * c_water * (t_final - t_ice)
* Warmte verloren door water: m_water * C_Water * (t_water - t_final)
* Warmte verloren door ijzer: m_iron * c_iron * (t_water - t_final)
4. Sluit de waarden aan en lost op:
(30 g * 334 j/g) + (30 g * 4.18 j/(g ° C) * (t_final - 0 ° C)) =(500 g * 4.18 j/(g ° C) * (45 ° C - t_final)) + (150 g * 0,45 j/(g ° C) * (45 ° C - T_final)))
5. Vereenvoudig en oplossen voor t_final:
* 10020 j + 125.4 j/° C * t_final =9390 j - 2090 j/° C * t_final + 3037.5 j - 67.5 j/° C * t_final
* 2283 J/° C * t_final =1578.5 J
* t_final ≈ 0,69 ° C
Daarom is de eindtemperatuur van het mengsel ongeveer 0,69 ° C.
 Colloïdale gels, alomtegenwoordig in alledaagse producten, hun geheimen prijsgeven
Colloïdale gels, alomtegenwoordig in alledaagse producten, hun geheimen prijsgeven Het natuurlijke vermogen van hout gebruiken om te buigen tijdens het drogen om gebogen structuren te creëren
Het natuurlijke vermogen van hout gebruiken om te buigen tijdens het drogen om gebogen structuren te creëren Welke conclusie zou u kunnen trekken als een positieve test voor een van de macromoleculen plaatsvond in buis die alleen zuiver water bevatte?
Welke conclusie zou u kunnen trekken als een positieve test voor een van de macromoleculen plaatsvond in buis die alleen zuiver water bevatte?  Wat zou een groot aantal aan het begin van de chemische formule Reprent Ex 3C2?
Wat zou een groot aantal aan het begin van de chemische formule Reprent Ex 3C2?  Hoe AI en diepere wortels de bodem kunnen helpen meer koolstof op te slaan
Hoe AI en diepere wortels de bodem kunnen helpen meer koolstof op te slaan
 Studie toont erosie van ozonlaag aan die verantwoordelijk is voor massale uitstervingsgebeurtenis
Studie toont erosie van ozonlaag aan die verantwoordelijk is voor massale uitstervingsgebeurtenis Welvarende landen hebben handel nodig om milieuproblemen te verminderen
Welvarende landen hebben handel nodig om milieuproblemen te verminderen Een groenblijvende boom die klinkt als ooi?
Een groenblijvende boom die klinkt als ooi?  Nieuwe tool voor vroege detectie van blauwalgen
Nieuwe tool voor vroege detectie van blauwalgen Studie voorspelt dat de oceanen ozonafbrekende CFK's gaan uitstoten
Studie voorspelt dat de oceanen ozonafbrekende CFK's gaan uitstoten
Hoofdlijnen
- Waarom slimme groei spelers in het systeem frustreert:studie
- Wat doodt de Minnesota-eland? Onderzoekers lanceren nieuwe inspanningen om erachter te komen
- Wetenschappers maken apparaat voor ultranauwkeurige genoomsequencing van afzonderlijke menselijke cellen
- Ontdek nieuwe details over antibioticaresistentie uit melkmonsters uit de jaren veertig
- Wat zijn de zes soorten bindweefsel in de biologie?
Bindweefsel is een van de vier belangrijkste weefseltypen bij zoogdieren, de andere zijn zenuwweefsel, spierweefsel en epitheel of oppervlakteweefsel. Epitheliaal weefsel ligt op bindweefsel terwi
- Wat is structuur?
- Hoe een ‘kwal’-vormige structuur de druk in je cellen verlicht
- Welke soorten planten zijn niet -leven?
- Wie zijn de vijf Filipijnse bioloog en hun uitvindingen?
- Wetenschappers maken vloeibare kristallen die veel op hun vaste tegenhangers lijken

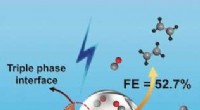
- Elektroreductie van koolmonoxide voor de zeer selectieve productie van ethyleen
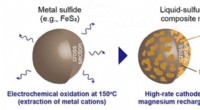
- Hoogwaardige oplaadbare magnesiumbatterijen komen een stap dichter bij realisatie
- Kleinste aardbevingen ooit gedetecteerd in metalen op micronschaal

- Onderzoekers ontdekken dat ruimte tussen polymeerketens de energieconversie beïnvloedt

 Gist brengt genetische variaties in de schijnwerpers die verband houden met resistentie tegen geneesmiddelen
Gist brengt genetische variaties in de schijnwerpers die verband houden met resistentie tegen geneesmiddelen Amerikaanse wetenschappers bestuderen de impact van uranium in de Grand Canyon-regio
Amerikaanse wetenschappers bestuderen de impact van uranium in de Grand Canyon-regio orang-oetans, zoals mensen, geneeskrachtige planten gebruiken om gewrichts- en spierontsteking te behandelen
orang-oetans, zoals mensen, geneeskrachtige planten gebruiken om gewrichts- en spierontsteking te behandelen Israël wordt ervan beschuldigd AI te gebruiken om duizenden mensen in Gaza aan te vallen, omdat killer-algoritmen het internationale recht voorbijstreven
Israël wordt ervan beschuldigd AI te gebruiken om duizenden mensen in Gaza aan te vallen, omdat killer-algoritmen het internationale recht voorbijstreven  Het simpele verschil tussen ballistische raketten en kruisraketten
Het simpele verschil tussen ballistische raketten en kruisraketten  Wiskunde en mechanica gebruiken om uit te leggen hoe tweekleppige schelpen zo goed in elkaar passen
Wiskunde en mechanica gebruiken om uit te leggen hoe tweekleppige schelpen zo goed in elkaar passen  Hoe ziet Moonstone eruit?
Hoe ziet Moonstone eruit?  Wat gebeurt er als de zeespiegel stijgt en het kustgebied onder water komt te staan?
Wat gebeurt er als de zeespiegel stijgt en het kustgebied onder water komt te staan?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

