
Wetenschap
Hoe lost een vaste stof op in vloeistof?
De basis
* Attractie is sleutel: Oplossing gaat helemaal over de balans van aantrekkelijke krachten. Wanneer een vaste stof oplost in een vloeistof, worden de moleculen van de vaste stof van elkaar weggetrokken en omgeven door de vloeibare moleculen.
* Solvation: Het proces van een solide oplossing wordt solvation genoemd . Dit is waar de oplosmiddelmoleculen (de vloeistof) omringen en interageren met de opgeloste moleculen (de vaste stof).
* zoals oplost zoals: Een van de belangrijkste regels is dat "zoals oplost zoals." Dit betekent dat polaire oplosmiddelen (zoals water) de neiging hebben om polaire opgeloste stoffen (zoals zout) op te lossen, terwijl niet -polaire oplosmiddelen (zoals olie) de neiging hebben om niet -polaire opgeloste stoffen (zoals vet) op te lossen.
Het gedetailleerde proces
1. Breekbindingen: Wanneer een vaste stof in een vloeistof wordt geplaatst, beginnen de oplosmiddelmoleculen te interageren met het oppervlak van de vaste stof. De oplosmiddelmoleculen proberen de bindingen te verbreken die de moleculen van de vaste stof in elkaar houden.
2. Solvatie treedt op: Als de aantrekkelijke krachten tussen het oplosmiddel en de opgeloste stof sterker zijn dan de aantrekkelijke krachten in de vaste stof, zullen de vaste moleculen beginnen te scheiden en omringd worden door oplosmiddelmoleculen.
3. Diffusie: De opgeloste opgeloste moleculen verspreiden zich vervolgens gelijkmatig over het oplosmiddel door een proces genaamd diffusie .
4. evenwicht: Uiteindelijk een punt van evenwicht wordt bereikt. Dit betekent dat de snelheid waarmee vaste moleculen oplossen gelijk is aan de snelheid waarmee opgeloste moleculen opnieuw in de vaste toestand gericht zijn.
factoren die de oplossing beïnvloeden
* Temperatuur: Hogere temperaturen verhogen meestal de oplossingsnelheid. Dit komt omdat de verhoogde kinetische energie van de moleculen hen helpt gemakkelijker uit elkaar te breken.
* roeren of agitatie: Het roeren of schudden van een oplossing helpt de oplossing te versnellen door verse oplosmiddelmoleculen in contact te brengen met de vaste stof.
* oppervlakte: Een groter oppervlak van de vaste stof zal sneller oplossen. Denk na over hoe een suikerkubus langzamer oplost dan kristalsuiker.
* Oplosmiddel -eigenschappen: Het gebruikte type oplosmiddel speelt een grote rol. Polaire oplosmiddelen, zoals water, zijn beter in het oplossen van polaire opgeloste stoffen. Niet -polaire oplosmiddelen zijn beter in het oplossen van niet -polaire opgeloste stoffen.
Voorbeeld:zout oplossen in water
1. Breekbindingen: De watermoleculen (polair) worden aangetrokken door de natrium- en chloride -ionen (polair) in het zoutkristal.
2. Solvatie: De watermoleculen omringen de ionen en trekken ze weg van het kristalrooster.
3. Diffusie: De opgeloste ionen verspreiden zich over het water.
4. evenwicht: De opgeloste zoutmoleculen zijn in evenwicht met het onopgeloste zoutkristal.
Laat het me weten als je dieper in een specifiek aspect van ontbinding wilt verdiepen!
 Eigenschappen van CO2-clathraathydraat
Eigenschappen van CO2-clathraathydraat Tijdens welk proces vormen gassen de oplossing die u ademt?
Tijdens welk proces vormen gassen de oplossing die u ademt?  Hoeveel koolstofatomen in een hoop diamant van 44,4 wortelen?
Hoeveel koolstofatomen in een hoop diamant van 44,4 wortelen?  Onderzoekers vinden nieuw bewijs over hoe cholesterol wordt verplaatst van HDL's naar LDL's
Onderzoekers vinden nieuw bewijs over hoe cholesterol wordt verplaatst van HDL's naar LDL's  Wat is het atoom dat het grootste gewicht in het menselijk lichaam vertegenwoordigt?
Wat is het atoom dat het grootste gewicht in het menselijk lichaam vertegenwoordigt?
 Ga naar het westen, jonge den:Amerikaanse bossen verschuiven door klimaatverandering
Ga naar het westen, jonge den:Amerikaanse bossen verschuiven door klimaatverandering Onderzoekers ontwikkelen een nieuw proces om te bestuderen hoe bomen de bouwtemperaturen beïnvloeden, luchtstroom bij extreme hitte
Onderzoekers ontwikkelen een nieuw proces om te bestuderen hoe bomen de bouwtemperaturen beïnvloeden, luchtstroom bij extreme hitte Aardbeving van vulkaan Etna schokt Sicilië, leidt tot paniek
Aardbeving van vulkaan Etna schokt Sicilië, leidt tot paniek Wat zijn de onderdelen van de microbiologie?
Wat zijn de onderdelen van de microbiologie?  Suomi NPP Satellite ziet tropische storm Ava in de buurt van Madagascar
Suomi NPP Satellite ziet tropische storm Ava in de buurt van Madagascar
Hoofdlijnen
- Hoe beslissen wetenschappers of ze al dan niet een hypothese moeten worden geaccepteerd?
- Wat zijn de soorten dichte bindweefsels?
- Wat wordt geproduceerd als reactie op hormonale activering van G -eiwitten?
- Wat is de dimensie buiten het waargenomen bereik voor menselijke cellen?
- Variatie is belangrijk:genetische effecten bij op elkaar inwerkende soorten bepalen samen ecologische resultaten
- Diversiteit van grote dieren speelt een belangrijke rol in koolstofcyclus
- Welke chemische stof wordt soms gebruikt om cellulair plastic te maken?
- Bepalen wat zich aan slijm bindt
- Wat is het aantal chromosomen in een edelsteen?
- Firefly-gen verlicht het vermogen van geoptimaliseerd CRISPR-Cpf1 om het menselijk genoom efficiënt te bewerken

- Onderzoekers ontwikkelen nieuwe methode om metaal te analyseren

- Testen van de antibacteriële eigenschappen van hydrofobe oppervlakken op het ISS

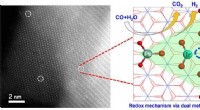
- Wetenschappers stellen redoxmechanisme voor water-gasverschuivingsreactie voor
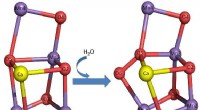
- Mechanisme van fotosynthetische watersplitsing onthuld door een röntgenvrije elektronenlaser
 Klimaatverandering maakte Franse hittegolf waarschijnlijker in heetste juni ooit
Klimaatverandering maakte Franse hittegolf waarschijnlijker in heetste juni ooit Nieuwe thermometriemethode laat zien dat het comprimeren van een gas tot afkoeling kan leiden
Nieuwe thermometriemethode laat zien dat het comprimeren van een gas tot afkoeling kan leiden  NASA-instrumentsleutel voor begrip van planeet op zonne-energie arriveert in Kennedy Space Center
NASA-instrumentsleutel voor begrip van planeet op zonne-energie arriveert in Kennedy Space Center Franse startup Plume probeert luchtkwaliteit te crowdsourcen
Franse startup Plume probeert luchtkwaliteit te crowdsourcen Waarom vormen metalen behalve Mg en Mn geen waterstof als ze reageren met salpeterzuur?
Waarom vormen metalen behalve Mg en Mn geen waterstof als ze reageren met salpeterzuur?  Hoe klimaatverandering het cultureel erfgoed beïnvloedt
Hoe klimaatverandering het cultureel erfgoed beïnvloedt  Verstandig tijd besteden:wat jongeren kunnen leren van gepensioneerden
Verstandig tijd besteden:wat jongeren kunnen leren van gepensioneerden Leg uit hoe steenkool een opslagplaats voor zonne-energie is?
Leg uit hoe steenkool een opslagplaats voor zonne-energie is?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

