
Wetenschap
Wat is de pH van een oplossing die 0,535 g NHCl bevat in 50 ml 0,1 m NH?
1. Begrijp de chemie
* NH₃ (ammoniak): Een zwakke basis.
* NH₄CL (ammoniumchloride): Het zout van een zwakke basis (NH₃) en een sterk zuur (HCl). Dit zout zal in water hydrolyseren, h⁺ -ionen produceren en de oplossing zuur maken.
2. Het evenwicht instellen
Het relevante evenwicht is de hydrolyse van het ammoniumion (NH₄⁺):
NH₄⁺ (aq) + h₂o (l) ⇌ nH₃ (aq) + h₃o⁺ (aq)
3. Bereken de initiële concentraties
* [NH₄⁺]:
- Molaire massa van NH₄cl =53,49 g/mol
- mol NH₄cl =0,535 g / 53,49 g / mol =0,01 mol
- [NH₄⁺] =0,01 mol / 0,05 L =0,2 m
* [NH₃]:
- [NH₃] =0,1 m (gegeven)
4. Gebruik de ijstafel
| | NH₄⁺ | H₂o | NH₃ | H₃o⁺ |
| ------------- | ---------- | ---------- | ---------- | ---------- |
| Initiaal (i) | 0,2 m | | 0,1 m | 0 |
| Verander (c) | -x | | +x | +x |
| Evenwicht (e) | 0.2-X | | 0.1+x | X |
5. Schrijf de evenwichtsuitdrukking
Kₐ voor NH₄⁺ is 5,6 x 10⁻¹⁰ (u kunt deze waarde vinden in een tabel met zure dissociatie -constanten)
Kₐ =[NH₃] [H₃o⁺] / [NH₄⁺] =(0.1+x) (x) / (0.2-X)
6. Benaderingen maken
Omdat Kₐ erg klein is, kunnen we aannemen dat X te verwaarlozen is in vergelijking met 0,1 en 0,2. Dit vereenvoudigt de vergelijking:
5.6 x 10⁻¹⁰ ≈ (0,1) (x) / 0,2
7. Oplossen voor x
x =[H₃o⁺] ≈ 1.12 x 10⁻⁹ m m
8. Bereken pH
pH =-log [h₃o⁺] =-log (1.12 x 10⁻⁹) ≈ 8.95
Daarom is de pH van de oplossing ongeveer 8,95.
 Mineralen zijn substantie samengesteld uit twee of meer elementen die in duidelijke verhoudingen aan elkaar zijn verbonden?
Mineralen zijn substantie samengesteld uit twee of meer elementen die in duidelijke verhoudingen aan elkaar zijn verbonden?  Het geheim van de plakkerigheid van mosselen onder water
Het geheim van de plakkerigheid van mosselen onder water Waarom een stroom plasma chemische reacties efficiënter maakt
Waarom een stroom plasma chemische reacties efficiënter maakt  Wat is L-cysteïne hydrochloride?
Wat is L-cysteïne hydrochloride?  Exhaust Dyeing Process
Exhaust Dyeing Process
 Hoe worden wind gevormd?
Hoe worden wind gevormd?  VAE ontdekt biljoenen kubieke voet ondiepe gasreserves
VAE ontdekt biljoenen kubieke voet ondiepe gasreserves De winning van fossiele brandstoffen beperken om de opwarming van de aarde onder de 1,5°C-doelstelling te houden
De winning van fossiele brandstoffen beperken om de opwarming van de aarde onder de 1,5°C-doelstelling te houden Kunnen deze slippers de aarde redden?
Kunnen deze slippers de aarde redden? Er is niet één maatstaf als je onderzoekt hoe koolstof in de bodem het klimaat beïnvloedt
Er is niet één maatstaf als je onderzoekt hoe koolstof in de bodem het klimaat beïnvloedt
Hoofdlijnen
- Nieuw onderzoek identificeert een bacterieel Jekyll en Hyde-molecuul dat betrokken is bij immuunreacties
- Wetenschappers gebruiken een supercomputer om te leren hoe cicadevleugels bacteriën doden
- Hoe worden veel orgelsystemen samengewerkt?
- Wat zou geen functioneel kenmerk van het leven zijn?
- Wat gebeurt er als weefsel wordt aangevallen door een virus?
- Wetenschapper duikt in honderden onderwatergrotten op zoek naar nieuwe vormen van leven
- Evolutie hoe werkt
- Waarom zeg je dat een enzym herbruikbaar is?
- Zijn rode algen en voorbeeld van een organisme uit de flagellate groep?
- De oppervlaktechemie van SARS-CoV-2 begrijpen
- Handdesinfecterend middel opnieuw ontwerpen en doneren 7, 000 gallons om COVID-19 te bestrijden

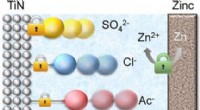
- Zink-ion hybride condensatoren met ideale anionen in de elektrolyt vertonen extra lange prestaties
- Twee stappen dichter bij flexibel, krachtig, snelle bio-elektronische apparaten
- Onderzoekers vinden een manier om het hele spectrum van zonlicht te benutten

 Definitie van Vertical Climate
Definitie van Vertical Climate Kan Twitter de volgende terroristische aanslag stoppen?
Kan Twitter de volgende terroristische aanslag stoppen?  Hubble detecteert kleinste bekende klontjes donkere materie
Hubble detecteert kleinste bekende klontjes donkere materie Efficiënte verwijdering van radionucliden U(VI) door nanomaterialen van staafvormig metaalorganisch raamwerk (MOF-5)
Efficiënte verwijdering van radionucliden U(VI) door nanomaterialen van staafvormig metaalorganisch raamwerk (MOF-5) Waarom denk je dat het hebben van soortgelijke embryo's wetenschappers dat twee phyla bij elkaar moeten worden vermeld?
Waarom denk je dat het hebben van soortgelijke embryo's wetenschappers dat twee phyla bij elkaar moeten worden vermeld?  Onderzoekers ontwikkelen nanostructuren om het vermogen van het immuunsysteem om kanker te bestrijden te verbeteren
Onderzoekers ontwikkelen nanostructuren om het vermogen van het immuunsysteem om kanker te bestrijden te verbeteren  Het overwinnen van fijne proceslimieten met linker-ionaffiniteit
Het overwinnen van fijne proceslimieten met linker-ionaffiniteit  Geïnspireerd door een suikerspinmachine, ingenieurs geven een nieuwe draai aan het maken van kleine nanovezels
Geïnspireerd door een suikerspinmachine, ingenieurs geven een nieuwe draai aan het maken van kleine nanovezels
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

