
Wetenschap
Wat is de relatie tussen atomaire getallen en ionische stralen van elementen in groep 3a?
Algemene trend:
* ionische radii neemt toe naarmate je naar beneden gaat groep 3a.
Verklaring:
* Atomisch nummer en elektronenschalen: Het atoomnummer neemt toe naarmate je de groep uitvoert. Dit betekent dat het aantal elektronenschalen toeneemt. Elke extra schaal draagt bij aan de grootte van het atoom.
* Afschermingseffect: Naarmate je de groep naar beneden gaat, neemt het aantal binnenste elektronen (kernelektronen) toe. Deze kernelektronen beschermen de buitenste valentie -elektronen tegen de aantrekkingskracht van de kern. Dit afschermingseffect vermindert de effectieve nucleaire lading die wordt gevoeld door de valentie -elektronen, waardoor ze een grotere ruimte kunnen innemen.
* ionische vorming: Groep 3A -elementen hebben de neiging om +3 ionen te vormen door hun drie valentie -elektronen te verliezen. Het verlies van deze elektronen leidt tot een afname van de afstoting van de elektronen-elektronen, waardoor het ion kleiner is dan het neutrale atoom. De toename van de grootte als gevolg van de extra elektronenschalen domineert echter nog steeds, wat resulteert in een algehele toename van ionische stralen terwijl u de groep doorgaat.
Voorbeeld:
* Boron (B) heeft de kleinste ionische straal, gevolgd door aluminium (AL), gallium (GA), indium (in) en thallium (TL).
Belangrijke opmerking: Er zijn enkele kleine variaties in de trend als gevolg van factoren zoals de D-blokcontractie en de lanthanide-contractie. De algehele trend van toenemende ionische stralen met toenemend atoomnummer in groep 3A blijft echter geldig.
 Grote doorbraak in de productie van rode bloedcellen
Grote doorbraak in de productie van rode bloedcellen Chemici creëren nieuwe diagnostische methode voor moeilijke klimatologische omstandigheden
Chemici creëren nieuwe diagnostische methode voor moeilijke klimatologische omstandigheden Welke waarden classificeert het beste een binding tussen 2 atomen die covalent zijn?
Welke waarden classificeert het beste een binding tussen 2 atomen die covalent zijn?  Wetenschappers ontwerpen nieuw responsief poreus materiaal geïnspireerd op eiwitten
Wetenschappers ontwerpen nieuw responsief poreus materiaal geïnspireerd op eiwitten Experimentele analyse en computersimulaties laten zien hoe composieten van geweven stoffen door hitte worden vervormd
Experimentele analyse en computersimulaties laten zien hoe composieten van geweven stoffen door hitte worden vervormd
 Vliegtuigcampagne om de chemie van natuurbrandrook te verduidelijken
Vliegtuigcampagne om de chemie van natuurbrandrook te verduidelijken Studie van Harvey-overstromingen helpt bij het kwantificeren van klimaatverandering
Studie van Harvey-overstromingen helpt bij het kwantificeren van klimaatverandering Gegevens uit Kilauea suggereren dat de uitbarsting ongekend was
Gegevens uit Kilauea suggereren dat de uitbarsting ongekend was De vierde landbouwrevolutie komt eraan, maar wie heeft er echt baat bij?
De vierde landbouwrevolutie komt eraan, maar wie heeft er echt baat bij? Himalaya winden spelen rol bij wolken- en vochttransport, water herverdeling
Himalaya winden spelen rol bij wolken- en vochttransport, water herverdeling
Hoofdlijnen
- Hoe boa's zichzelf behoeden voor verstikking bij het vernauwen en verteren van het avondeten
- Wat kunnen haaien ons leren over ons hart?
- Studie vindt potentiële celreceptoren om antibioticaresistentie te verminderen
- Hoe glyfosaat de broedzorg bij hommels beïnvloedt
- Twee methoden om aan te tonen hoe fotolyase-isolaten licht gebruiken om beschadigd DNA te repareren
- Welke bestaat uit vergelijkbare typencellen en voert een specifieke functie uit?
- Hoe is DNA vergelijkbaar met Morse -code?
- Sommige microben op de zeebodem kunnen de hitte verdragen:dit is wat ze eten
- Wat is essentieel voor het handhaven van de geloofwaardigheid van een wetenschapper?
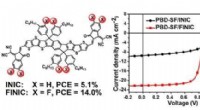
- Onderzoekers ontwikkelen elektronenacceptor met gefuseerde ring met 3D-exciton en ladingstransport
- Onderzoek onthult waarom het moeilijk is om de geur uit polyester te krijgen

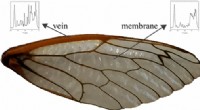
- Hoe krekels erin slagen om het te vleugelen
- Test bepaalt personen die waarschijnlijk DNA afstaan op plaats delict

- Video:Moet je plassen op een kwallensteek?
 Vormen water en suiker een elektrolytoplossing?
Vormen water en suiker een elektrolytoplossing?  Marswater was mineraalrijk en zout
Marswater was mineraalrijk en zout Mechanisme en evolutieproces van superkritische vloeistof
Mechanisme en evolutieproces van superkritische vloeistof Waarom gebruik je galvanometer?
Waarom gebruik je galvanometer?  Waarom is de grootte van een ion groter dan zijn ouderatoom?
Waarom is de grootte van een ion groter dan zijn ouderatoom?  Wat wordt gemaakt door fotosynthese?
Wat wordt gemaakt door fotosynthese?  Zijn Titans-duinen gemaakt van kometenstof?
Zijn Titans-duinen gemaakt van kometenstof?  Welke term beschrijft de beweging van allelen naar een populatie?
Welke term beschrijft de beweging van allelen naar een populatie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

