
Wetenschap
Wat maakt regio's van een watermolecuul positiever dan negatief?
1. Het "hebzucht" van het zuurstofatoom:
* elektronegativiteit: Zuurstof is een zeer elektronegatief atoom, wat betekent dat het een sterke aantrekkingskracht heeft op elektronen. Dit betekent dat het elektronen "trekt" in een covalente binding aan zichzelf sterker dan waterstof.
* ongelijke delen: In een watermolecuul (H₂o) trekt het zuurstofatoom de gedeelde elektronen aan in de covalente bindingen met de waterstofatomen. Dit resulteert in het zuurstofatoom met een enigszins negatieve lading (δ-) en de waterstofatomen met enigszins positieve ladingen (Δ+).
2. De gebogen vorm:
* Geometrie van het water: Het watermolecuul heeft een gebogen vorm vanwege de twee eenzame paren elektronen op het zuurstofatoom. Deze enige paren afstoten de waterstofatomen, duwen ze dichter bij elkaar en creëren een gebogen configuratie.
* polariteit: Deze gebogen vorm betekent dat de positieve ladingen van de waterstofatomen geconcentreerd zijn aan één zijde van het molecuul, terwijl de negatieve lading van het zuurstofatoom aan de andere kant is geconcentreerd.
3. Het resultaat:een polair molecuul:
* dipolen: De ongelijke delen van elektronen en de gebogen vorm creëren een permanente ladingscheiding in het watermolecuul. Dit wordt een dipoolmoment genoemd.
* Aantrekking en interactie: Met deze dipolen kan watermoleculen sterke waterstofbruggen met elkaar en andere polaire moleculen vormen. Deze sterke aantrekkingskracht is verantwoordelijk voor de unieke eigenschappen van het water, zoals het hoge kookpunt en het vermogen om veel stoffen op te lossen.
Samenvattend:
De combinatie van de elektronegativiteit van zuurstof, het ongelijke delen van elektronen en de gebogen vorm van het watermolecuul creëert een permanent dipoolmoment, wat leidt tot afzonderlijke positieve en negatieve gebieden in het molecuul.
 Nieuw systeem voor vroegtijdige waarschuwing bij bosbranden kan voorjaarsbranden voorkomen
Nieuw systeem voor vroegtijdige waarschuwing bij bosbranden kan voorjaarsbranden voorkomen Koele daken hebben ook waterbesparende voordelen
Koele daken hebben ook waterbesparende voordelen De baanveranderingen van de aarde hebben het klimaat beïnvloed, levensvormen gedurende ten minste 215 miljoen jaar
De baanveranderingen van de aarde hebben het klimaat beïnvloed, levensvormen gedurende ten minste 215 miljoen jaar Welk doel moet eerst worden gebruikt bij het bekijken van een object?
Welk doel moet eerst worden gebruikt bij het bekijken van een object?  Surveillance in Big Brother-stijl geeft nieuw inzicht in verborgen dieren in het Amazonegebied
Surveillance in Big Brother-stijl geeft nieuw inzicht in verborgen dieren in het Amazonegebied
Hoofdlijnen
- Waarom heeft een regenworm een gesloten bloedsomloop?
- Welke schimmels doen met zetmeel?
- Chimerisme:je kunt je eigen tweeling zijn
- Hoe regelt de celmembraanbeweging van materialen in en uit cel?
- In de stad levende pimpelmezen kunnen grotere eieren leggen vanwege wat ze eten
- Waarom maken bacteriën hun eigen foliumzuur?
- Waarom vleermuizen virussen met zich meedragen die bij mensen een hoger sterftecijfer hebben dan bij andere zoogdieren
- Wat zit er in een naam? Big Data onthult onderscheidende patronen in hogeronderwijssystemen
- Welk deel van bacteriën herbergt het genetische materiaal?
- Bio-ingenieurs zetten stap in de richting van een patch die een gebroken hart kan herstellen

- Goedkoop, energiezuinige aanpak voor de behandeling van met zware metalen verontreinigd water

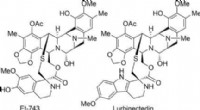
- Totale synthese van mariene antitumormiddelen trabectedine en lurbinectedine
- Nieuwe fotokatalysatoren kunnen door zonne-energie aangedreven omzetting van koolstofdioxide in brandstof uitvoeren

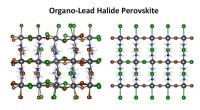
- Wetenschappers ontwikkelen innovatieve technieken voor analyse met hoge resolutie van hybride materialen
 Het type berg dat zich vormt wanneer rotslagen samen worden geperst en omhoog geduwd?
Het type berg dat zich vormt wanneer rotslagen samen worden geperst en omhoog geduwd?  Robot Pingpong Coach helpt spelers hun tafeltennisspel te verbeteren
Robot Pingpong Coach helpt spelers hun tafeltennisspel te verbeteren  Zal de pandemie-ervaring ons helpen de klimaatverandering aan te pakken?
Zal de pandemie-ervaring ons helpen de klimaatverandering aan te pakken? Kan het beschermen van onze eiwitten ons helpen veroudering te voorkomen?
Kan het beschermen van onze eiwitten ons helpen veroudering te voorkomen?  Het Japanse Toshiba verlaagt de winstvooruitzichten opnieuw
Het Japanse Toshiba verlaagt de winstvooruitzichten opnieuw Duurzame start-ups moeten eerst corporate venture capital overwegen
Duurzame start-ups moeten eerst corporate venture capital overwegen Belangrijk nieuw model laat zien hoe eiwitten de juiste DNA-sequenties vinden
Belangrijk nieuw model laat zien hoe eiwitten de juiste DNA-sequenties vinden  Hoe lineaire dichtheid te berekenen
Hoe lineaire dichtheid te berekenen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

