
Wetenschap
Wat is de hydroxide -ionenconcentratie van een oplossing die 1N NaOH bevat?
Inzicht in normaliteit en molariteit
* normaliteit (n): Vertegenwoordigt het aantal equivalenten van een opgeloste oplossing. Voor NaOH bevat één mol één equivalent van hydroxide-ionen (OH-).
* molariteit (m): Vertegenwoordigt het aantal mol van een opgeloste oplossing.
In het geval van NaOH:
* Aangezien één mol NaOH één equivalent van OH- bevat, zijn de normaliteit en molariteit van NaOH-oplossingen numeriek gelijk.
* Daarom is een 1N NaOH -oplossing ook een 1M NaOH -oplossing.
concentratie van hydroxide -ionen
* NaOH dissocieert volledig in water:NaOH (aq) → Na + (aq) + oh- (aq)
* Dit betekent dat voor elke mol van NaOH opgelost, één mol oh-ionen wordt geproduceerd.
Conclusie
Aangezien een 1N NaOH-oplossing gelijk is aan een 1M NaOH-oplossing, is de hydroxide-ionenconcentratie [OH-] 1 m of 1 mol/l .
 Wat zijn producten en waar bevinden ze zich in chemische vergelijkingen?
Wat zijn producten en waar bevinden ze zich in chemische vergelijkingen?  Supersterke Al-legeringen kunnen de productieprocessen voor auto's veranderen, ruimtevaartapparatuur
Supersterke Al-legeringen kunnen de productieprocessen voor auto's veranderen, ruimtevaartapparatuur 2D-materialen tot het uiterste brengen
2D-materialen tot het uiterste brengen Gecko-adhesietechnologie komt dichter bij industrieel gebruik
Gecko-adhesietechnologie komt dichter bij industrieel gebruik Nieuwe interactie tussen dunne-filmmagneten voor snellere geheugenapparaten
Nieuwe interactie tussen dunne-filmmagneten voor snellere geheugenapparaten
 Koolstof op de loer in diepe oceaan gooide oude klimaatschakelaar, zeggen onderzoekers
Koolstof op de loer in diepe oceaan gooide oude klimaatschakelaar, zeggen onderzoekers Zonder werk in lockdown, touroperators hielpen bij het vinden van koraalverbleking op de afgelegen riffen van West-Australië
Zonder werk in lockdown, touroperators hielpen bij het vinden van koraalverbleking op de afgelegen riffen van West-Australië Nieuw boek onderzoekt wat religieuze Amerikanen denken over wetenschap
Nieuw boek onderzoekt wat religieuze Amerikanen denken over wetenschap  Achtervolgende reuzen:aanwijzingen voor hoe mensen en giraffen samen kunnen gedijen
Achtervolgende reuzen:aanwijzingen voor hoe mensen en giraffen samen kunnen gedijen  Ecologisch belang van algae
Ecologisch belang van algae
Hoofdlijnen
- Waar komen Australische katten vandaan?
- AI-tool maakt synthetische afbeeldingen van cellen voor verbeterde microscopieanalyse
- Opinie:het wegen van in het laboratorium gekweekte biefstuk - de problemen met het eten van vlees zijn geen Silicon Valleys om op te lossen
- Hoe planten microben benutten om voedingsstoffen binnen te krijgen
- Begrijpen hoe cellen elektrische velden volgen
- Is er een manier om te voorkomen dat de hond van Biden mensen bijt?
- Heeft glucose een transporteiwit nodig?
- Biologen op het spoor van hersenetende amoeben
- Wat is de functie van een selectief permeabel celmembraan?
- VTT ontwikkelde een optische vezel van cellulose

- Team ontwikkelt een elektrochemische methode om uranium te winnen, en mogelijk andere metaalionen, van oplossing
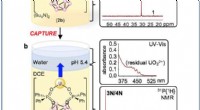
- Onderzoekers creëren vloeistofafstotende substantie die op alle oppervlakken werkt

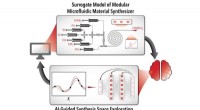
- Virtueel lab vindt de juiste AI-tool voor elk scheikundeprobleem
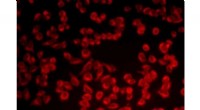
- Chemici ontwikkelen nieuwe Washington Red-kleurstof voor bio-imaging
 Is zinksulfide een sterke of zwakke elektrolyt?
Is zinksulfide een sterke of zwakke elektrolyt?  Waarom kunnen we speurhonden niet vervangen door elektronische neuzen?
Waarom kunnen we speurhonden niet vervangen door elektronische neuzen?  Resten van bosbranden kunnen bijdragen aan klimaatverandering
Resten van bosbranden kunnen bijdragen aan klimaatverandering Hoeveel mol zuurstof wordt geproduceerd uit twaalf kaliumchloraat?
Hoeveel mol zuurstof wordt geproduceerd uit twaalf kaliumchloraat?  Californiërs gevraagd om energie te besparen te midden van brute hittegolf
Californiërs gevraagd om energie te besparen te midden van brute hittegolf Fungus Vs. Mold
Fungus Vs. Mold Quantumprocessors weven uit laserlicht
Quantumprocessors weven uit laserlicht Supervulkaanuitbarsting kan het periodieke windsysteem in de tropische stratosfeer veranderen
Supervulkaanuitbarsting kan het periodieke windsysteem in de tropische stratosfeer veranderen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

