
Wetenschap
Gas A is 16 keer als dicht B Hoe verhouden hun diffusiesnelheden zich. welke men sneller verspreidt. door veel?
Inzicht in de wet van Graham
De diffusienet van Graham stelt dat de snelheid van diffusie van een gas omgekeerd evenredig is met de vierkantswortel van zijn molaire massa.
* Hogere molaire massa =langzamere diffusie
* Lagere molaire massa =snellere diffusie
Het toepassen van de wet van Graham
1. Dichtheid en molaire massa: Omdat de dichtheid direct gerelateerd is aan molaire massa (uitgaande van constante druk en temperatuur), kunnen we de dichtheidsverhouding gebruiken om hun diffusiesnelheden te vergelijken.
2. Bereken de verhouding:
* Gas A is 16 keer dichter dan gas B. Dit betekent dat gas A 16 keer de molaire gasmassa van gas B. heeft.
* Laten we zeggen dat de molaire gasmassa B 'M' is. Dan is de molaire gasmassa A '16m'.
3. diffusiesnelheidsverhouding:
* Diffusiesnelheid van gas A / diffusiesnelheid van gas B =√ (molaire massa van B) / √ (molaire massa van A)
* Diffusiesnelheid van gas a / diffusiesnelheid van gas b =√ (m) / √ (16m) =1/4
Conclusie
* Gas B diffuseert vier keer sneller dan gas a. Dit komt omdat het een aanzienlijk lagere molaire massa heeft (en dus een lagere dichtheid).
 Hoe wordt het genoemd als een reactiever metaal minder verbindingen vervangt?
Hoe wordt het genoemd als een reactiever metaal minder verbindingen vervangt?  Hoeveel moleculen zitten er in kaliumchloride?
Hoeveel moleculen zitten er in kaliumchloride?  Wat is de jodiumfase bij kamertemperatuur?
Wat is de jodiumfase bij kamertemperatuur?  Nieuw membraanwaterbehandelingssysteem om giftig afval en afvalverwerkingskosten met meer dan 90 procent te verminderen
Nieuw membraanwaterbehandelingssysteem om giftig afval en afvalverwerkingskosten met meer dan 90 procent te verminderen In elkaar grijpende ringen ontgrendelen nieuwe materiaaleigenschappen
In elkaar grijpende ringen ontgrendelen nieuwe materiaaleigenschappen
 22 doden door supercycloon die Bangladesh teistert India
22 doden door supercycloon die Bangladesh teistert India Hoe weet je waar vulkanische as terecht zal komen?
Hoe weet je waar vulkanische as terecht zal komen? Het herstellen van veenmoerassen kan de klimaatverandering vertragen - en een vergeten wereld nieuw leven inblazen
Het herstellen van veenmoerassen kan de klimaatverandering vertragen - en een vergeten wereld nieuw leven inblazen Wat is de temperatuur 's nachts in een tropisch regenwoud?
Wat is de temperatuur 's nachts in een tropisch regenwoud?  Doorbraak in debat over recente toename methaan in de atmosfeer
Doorbraak in debat over recente toename methaan in de atmosfeer
Hoofdlijnen
- Een evolutiepatroon waarin iets verschillende soorten evolueren van één gemeenschappelijke voorouder?
- Hoe bacteriën in vivo bacteriofagen ontwijken
- Gepolariseerde microscopietechniek toont nieuwe details van hoe eiwitten zijn gerangschikt
- Wat is een mutatie en waarom zijn mutaties belangrijk in evolutie?
- Hoe heeft de evolutietheorie de wetenschap geholpen?
- Hoe wordt het genoemd als een cel in grootte of aantal toeneemt?
- Waarom is de hypothese zo belangrijk voor de wetenschappelijke methode?
- Wordt Phlogiston als een wetenschappelijke kennis beschouwd?
- Wat is het verschil tussen citroenzuurmono en anhydrus?
- Onderzoek peilt naar de moleculaire bouwstenen voor lichtgevoelige materialen

- Grafeen-adsorbaat van der Waals bindingsgeheugen inspireert slimme grafeensensoren
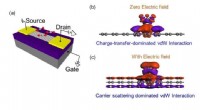
- Stabiele radicalen kunnen onconventionele problemen in de moderne wetenschap en technologie oplossen

- Gemanipuleerde gist kan het bereik van biobrandstoffen vergroten

- Kunstmatig enzym kan een gen-switch activeren
 Waarom zijn overstromingen in KwaZulu-Natal in Zuid-Afrika zo verwoestend? Stedenbouwkundige legt uit
Waarom zijn overstromingen in KwaZulu-Natal in Zuid-Afrika zo verwoestend? Stedenbouwkundige legt uit  Onderzoekers brengen dramatische achteruitgang in genetische diversiteit van noordwestelijke zalm in kaart
Onderzoekers brengen dramatische achteruitgang in genetische diversiteit van noordwestelijke zalm in kaart Lijst met Savanne-dieren
Lijst met Savanne-dieren Dynamische compressie biedt nieuw inzicht in het begrijpen en voorspellen van kristalgroei
Dynamische compressie biedt nieuw inzicht in het begrijpen en voorspellen van kristalgroei Wetenschappers stellen machinale leermethode voor 2D-materiaalspectroscopie voor
Wetenschappers stellen machinale leermethode voor 2D-materiaalspectroscopie voor Onderzoekers laten zien dat korte laserpulsen selectief gouden nanodeeltjes verwarmen
Onderzoekers laten zien dat korte laserpulsen selectief gouden nanodeeltjes verwarmen Waar is de sneeuw? Niet in de grootste stad van Alaska
Waar is de sneeuw? Niet in de grootste stad van Alaska  Hoe worden vliegtuigen groener?
Hoe worden vliegtuigen groener?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

