
Wetenschap
Heeft de postulaat 4 van de Atomic -theorie van Daltons nu waar?
Dit is waarom:
* isotopen: We weten nu dat atomen van hetzelfde element verschillende aantallen neutronen kunnen hebben. Deze verschillende vormen worden isotopen genoemd. Hoewel isotopen van hetzelfde element hetzelfde aantal protonen (en dus hetzelfde atoomnummer) delen, hebben ze verschillende massa's vanwege het variërende aantal neutronen. Dit is in tegenspraak met het idee van Dalton van identieke massa voor alle atomen van een element.
* Nucleaire reacties: Dalton's theorie dateert van vóór de ontdekking van nucleaire reacties. We begrijpen nu dat atomen kunnen worden gesplitst, versmolten en zelfs kunnen worden omgezet in andere elementen via nucleaire processen. Dit toont aan dat atomen niet ondeelbaar zijn, zoals Dalton geloofde.
Het vierde postulaat van Dalton kan echter worden beschouwd als een geldige benadering voor veel chemische reacties. In de meeste dagelijkse chemische reacties zijn de verschillen in massa en eigenschappen tussen isotopen onbeduidend. Het chemische gedrag van atomen wordt voornamelijk bepaald door hun elektronenconfiguratie, die grotendeels wordt bepaald door het aantal protonen.
Daarom, hoewel het vierde postulaat van Dalton niet volledig nauwkeurig is, bood het een fundamenteel kader voor de ontwikkeling van de moderne atoomtheorie. Het was een belangrijke stap voorwaarts in ons begrip van materie, ook al is het verfijnd en uitgebreid.
Hoofdlijnen
- Genenstroom bij giraffen en wat dit betekent voor hun behoud
- Wat eten Angelfish in het wild?
- Waarom is evolutie een theorie?
- Ecologische successie: definitie, types, stadia en voorbeelden
- Beschrijf hoe u gistcellen zou kunnen produceren die menselijke groeihormoon maken?
- Wat is het anaërobe leven?
- Ik heb bloedgroep A en weet dat A op de een of andere manier anders is dan de andere typen, maar ik zou graag willen wat ze zijn.?
- Een JELL-O-model van een diercel maken
- Boren koolhydraten erfelijke informatie op en verzenden ze erfelijke informatie?
- Zijdevezels kunnen hightech natuurlijke metamaterialen zijn

- Wetenschappers ontwikkelen N-gedoteerde zelfreinigende membranen die gebruik maken van bestraling met zichtbaar licht
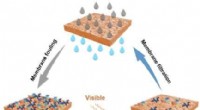
- Metaal-organische raamwerken kunnen ondanks de aanwezigheid van water gassen scheiden

- Bevindingen bieden recept voor fijnafstemming van legeringen voor gebruik bij hoge temperaturen

- Hoe een enkele katalysator op twee manieren koolstofdioxide in brandstof kan omzetten
 Wat is het type binding C7H6O3?
Wat is het type binding C7H6O3?  Kerkuilen kunnen de sleutel zijn tot navigatie en locatie
Kerkuilen kunnen de sleutel zijn tot navigatie en locatie Wat is oppervlak?
Wat is oppervlak?  Steen, schaar, bloem, doos. Uitkijk informeert blinden
Steen, schaar, bloem, doos. Uitkijk informeert blinden Onderzoekers ontdekken een milieuvriendelijk fungicidenalternatief
Onderzoekers ontdekken een milieuvriendelijk fungicidenalternatief  Mijlpaal op weg naar het inschakelen van 's werelds grootste supergeleidende lineaire versneller
Mijlpaal op weg naar het inschakelen van 's werelds grootste supergeleidende lineaire versneller Prebiotische atmosfeer ontdekt op accretieschijf van babyster
Prebiotische atmosfeer ontdekt op accretieschijf van babyster Nieuw productieproces voor NiO/Ni-nanocomposietelektroden voor supercondensatoren
Nieuw productieproces voor NiO/Ni-nanocomposietelektroden voor supercondensatoren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


