
Wetenschap
Hebben alle niet -metalen een volledig volle valentie -schaal van elektronen?
Dit is waarom:
* valentie -shell: Dit is de buitenste schaal van elektronen in een atoom. Het is de schaal die betrokken is bij chemische binding.
* niet -metalen: Deze elementen krijgen meestal elektronen om een volledige valentie -schaal te bereiken. Ze worden aangetroffen aan de rechterkant van de periodiek systeem (behalve voor waterstof).
Voorbeelden:
* stikstof (n): Heeft 5 valentie -elektronen en heeft nog 3 nodig om zijn schaal te vullen.
* zuurstof (O): Heeft 6 valentie -elektronen en heeft er nog 2 nodig om zijn schaal te vullen.
* chloor (CL): Heeft 7 valentie -elektronen en heeft nog 1 nodig om zijn schaal te vullen.
Uitzonderingen:
* Groep 18 (edelgassen): Deze elementen hebben per definitie een volledige valentie -shell. Ze zijn uitzonderlijk niet -reactief omdat ze geen elektronen hoeven te winnen of verliezen.
* Sommige niet -metalen in groep 17 (halogenen) en groep 16 (chalcogenen): Kan covalente bindingen vormen door elektronen te delen, wat kan leiden tot een situatie waarin ze geen volledig volledige valentieschelpen hebben.
Sleutelpunten:
* Niet -metalen hebben de neiging elektronen te krijgen om een stabiele, volledige valentieschelp te bereiken.
* Het doel is om de elektronenconfiguratie van een edelgas te bereiken.
* Sommige niet -metalen kunnen covalente bindingen vormen en elektronen delen, waardoor hun valentie -schaal gedeeltelijk wordt gevuld.
 Waarom verre bergen er met het blote oog blauw uitzien
Waarom verre bergen er met het blote oog blauw uitzien  Hoe klimaatverandering nieuwe epidemieën aan het licht zou kunnen brengen
Hoe klimaatverandering nieuwe epidemieën aan het licht zou kunnen brengen  Oproep tot paradigmaverschuiving om de verspreiding van COVID-19 door de lucht binnenshuis te bestrijden
Oproep tot paradigmaverschuiving om de verspreiding van COVID-19 door de lucht binnenshuis te bestrijden Wat is het kenmerk van een goede gemeenschap?
Wat is het kenmerk van een goede gemeenschap?  Hoe gebruiken mensen natuurlijke hulpbronnen op aarde?
Hoe gebruiken mensen natuurlijke hulpbronnen op aarde?
Hoofdlijnen
- Welk fenotype wordt geproduceerd door AA -genotype?
- Is een carriereiwit een actief transport of passief transport?
- Het is prima om in mei te maaien; de beste manier om bestuivers te helpen is door inheemse planten toe te voegen
- De rol van Taq-polymerase in PCR
- Welk deel van cellulaire ademhaling moet plaatsvinden voordat een andere stap kan optreden?
- Wat zijn specifieke celtypen?
- Cladistics: Definitie, methode en voorbeelden
- Wat zijn dingen in het huis die micro -organismen kunnen doden?
- Wetenschappers leggen uit waarom insecten niet dik worden
- Microbieel geïnduceerde carbonaatneerslag kan grofkorrelige, zoute grond verbeteren

- De oorzaak van capaciteitsverlies vinden in een metaaloxide batterijmateriaal

- Veelzijdige bouwstenen maken constructies met verrassende mechanische eigenschappen

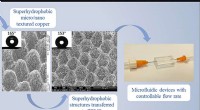
- Nieuw productieproces creëert superkleine kanalen om water af te weren en medische, elektronische apparaten
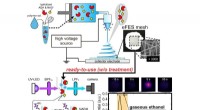
- Bouw van betere biosensoren in de gasfase voor de bestrijding van ziekten
 NASA vindt Nadine een compacte tropische storm
NASA vindt Nadine een compacte tropische storm Is er iets in de naam zinkfosfide dat aangeeft dat er drie en twee fosforionen zijn?
Is er iets in de naam zinkfosfide dat aangeeft dat er drie en twee fosforionen zijn?  Robots helpen hun omgeving te analyseren
Robots helpen hun omgeving te analyseren Diepblauwe organische lichtemitterende diodes op basis van een doublet-emissie cerium(III)-complex
Diepblauwe organische lichtemitterende diodes op basis van een doublet-emissie cerium(III)-complex Dagelijks gebruik van polynomen
Dagelijks gebruik van polynomen  Wat een hoop afval:uit nieuw onderzoek blijkt dat het Britse zwerfvuil wordt gedomineerd door plastic en drankverpakkingen
Wat een hoop afval:uit nieuw onderzoek blijkt dat het Britse zwerfvuil wordt gedomineerd door plastic en drankverpakkingen  Hoeveel oceanen zijn er?
Hoeveel oceanen zijn er?  Welke laboratoriumapparatuur wordt gebruikt voor het drogen van zouten?
Welke laboratoriumapparatuur wordt gebruikt voor het drogen van zouten?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

