
Wetenschap
Waarom condenseert een gas wanneer deze wordt gekoeld?
De rol van kinetische energie
* gas: In een gas liggen moleculen ver uit elkaar en bewegen vrij met hoge kinetische energie (beweging van de beweging). Ze botsen vaak, maar deze botsingen zijn elastisch, wat betekent dat er geen energie verloren gaat.
* Koeling: Wanneer u een gas koelt, vermindert u de gemiddelde kinetische energie van de moleculen. Ze beginnen langzamer te bewegen.
Aantrekkelijke krachten
* intermoleculaire krachten: Hoewel gasmoleculen ver uit elkaar liggen, zijn er zwakke aantrekkelijke krachten tussen hen. Deze krachten worden intermoleculaire krachten genoemd.
* Koeling en aantrekkingskracht: Naarmate de moleculen vertragen door koeling, worden deze aantrekkelijke krachten belangrijker. Ze kunnen de kinetische energie overwinnen die de moleculen uit elkaar duwt.
condensatie:
* dichter bij elkaar: De aantrekkelijke krachten trekken de moleculen dichter bij elkaar.
* vloeibare status: Wanneer de moleculen dichtbij genoeg komen en de aantrekkelijke krachten domineren, gaan ze over van een gas naar een vloeibare toestand. Dit is condensatie.
Voorbeeld:
Stel je voor dat stoom (waterdamp) oprijst uit een warm kopje thee. Terwijl de stoom wegloopt van de warmtebron, koelt deze af. De watermoleculen verliezen kinetische energie, de aantrekkelijke krachten worden sterker en de stoom condenseert in kleine waterdruppeltjes die de bekende wolk van 'stoom' vormen.
Sleutelpunten:
* Temperatuur: Condensatie treedt op wanneer de temperatuur van een gas onder zijn condensatiepunt daalt (de temperatuur waarbij het overgaat van een gas naar een vloeistof).
* Druk: Druk speelt ook een rol. Toenemende druk kan moleculen dichter bij elkaar dwingen, waardoor condensatie waarschijnlijker is.
Laat het me weten als je meer wilt weten over intermoleculaire krachten!
Hoofdlijnen
- Een vlieg heeft twee allelen voor de kleur van zijn ogen. Het groene allel is recessief en wordt vertegenwoordigd door blauw dominant, p. Als er 28 organismen zijn, welke p?
- Red Delicious of Wolf-appel? Braziliaanse savannevruchten met een hoog gehalte aan antioxidanten
- Waarom dacht Gregor Mendel dat genen die zijn geërfd in paren?
- Wat is de betekenis van de medische term die wordt veroorzaakt door defecte genen?
- Apple-CEO Tim Cook legt uit waarom hij zich uitsprak over immigratie
- Wat is bio-infomatica?
- Studie:Hoe roodrot suikerriet aantast
- Wat zijn biotische factoren die de structuur van biologische gemeenschappen kunnen beïnvloeden?
- Wat is het belang van nucleïnezuren?
- De chemische geheimen achter de allure van vanille

- Stuiterende bubbels schudden emulsiestudies op

- Gevouwen papier creëert een draagbaar laboratorium voor veldlaboratoriumtests
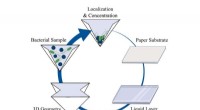
- Instant waterreinigingsmethode miljoenen keren beter dan commerciële aanpak

- Nabij-infraroodsonde decodeert de dynamiek van telomeren
 Webbs mid-infrared spectroscopie zal moleculen, elementen onthullen
Webbs mid-infrared spectroscopie zal moleculen, elementen onthullen Hoe verschillen bryophytes van andere plantendivisies?
Hoe verschillen bryophytes van andere plantendivisies?  De schaduw van Saturnusmaan Titan vastleggen vanaf hier op aarde
De schaduw van Saturnusmaan Titan vastleggen vanaf hier op aarde Hebben olie en water hetzelfde kookpunt?
Hebben olie en water hetzelfde kookpunt?  Waarom is vergroting belangrijk in de wetenschap?
Waarom is vergroting belangrijk in de wetenschap?  De zon als een ster bestuderen om steruitbarstingen en exoplaneten te begrijpen
De zon als een ster bestuderen om steruitbarstingen en exoplaneten te begrijpen Hoe heten de mannelijke en vrouwelijke geslachtscellen?
Hoe heten de mannelijke en vrouwelijke geslachtscellen?  Loont het organiseren van de Olympische Spelen, het WK of andere grote sportevenementen echt de moeite?
Loont het organiseren van de Olympische Spelen, het WK of andere grote sportevenementen echt de moeite?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


