
Wetenschap
Hoe zou de interactie van atomen en hun elektronen verschillen in een covalente binding?
Covalente binding
* delen van elektronen: In een covalente binding delen atomen elektronen. Dit delen is het bepalende kenmerk van een covalente binding.
* niet-metaal-nonmetaal interactie: Covalente bindingen vormen zich meestal tussen niet -metalen, die een sterke affiniteit hebben voor elektronen.
* Sterke binding: Covalente bindingen zijn over het algemeen sterk en vereisen aanzienlijke energie om te breken.
* Vorming van moleculen: Covalente bindingen leiden tot de vorming van discrete moleculen.
* Gelijke of ongelijke delen:
* Niet -polaire covalent: De elektronen worden gelijkelijk gedeeld tussen de atomen, wat resulteert in een evenwichtige ladingsverdeling.
* Polar covalent: De elektronen worden ongelijk gedeeld, waardoor het ene atoom een enigszins negatieve lading heeft en het andere een enigszins positieve lading heeft.
Andere soorten binding (voor vergelijking)
* ionische binding: Het ene atoom (meestal een metaal) brengt een of meer elektronen over naar een ander atoom (meestal een niet -metaal). Dit resulteert in de vorming van ionen met tegengestelde ladingen die elkaar aantrekken.
* Metallic binding: Elektronen worden gedelokaliseerd in een rooster van metaalatomen. Dit creëert een "zee" van elektronen die vrij kunnen bewegen, wat leidt tot de karakteristieke eigenschappen van metalen zoals geleidbaarheid en kneedbaarheid.
Belangrijkste verschillen:
* Elektronenoverdracht versus delen: Het belangrijkste verschil tussen covalente en andere soorten bindingen ligt in hoe elektronen worden behandeld. In covalente bindingen worden elektronen gedeeld. In ionische en metaalbindingen worden elektronen overgedragen of gedelokaliseerd.
* bindingssterkte: Covalente bindingen zijn meestal sterker dan ionische bindingen maar zwakker dan metaalbindingen.
* Soorten atomen: Covalente bindingen vormen zich tussen niet -metalen, terwijl ionische bindingen zich vormen tussen metalen en niet -metalen. Metaalbindingen vormen zich tussen metaalatomen.
Voorbeeld:
* covalent: Water (H₂o) - De waterstof- en zuurstofatomen delen elektronen, die een polaire covalente binding vormen.
* ionisch: Natriumchloride (NaCl) - Natrium draagt een elektron over naar chloor en vormt Na+ en clionen die elkaar aantrekken.
* Metallic: Koper (Cu) - De koperatomen delen een pool van elektronen, wat leidt tot zijn hoge geleidbaarheid en kneedbaarheid.
Laat het me weten als je een meer diepgaande uitleg van een bepaald aspect wilt!
 Geofysici en atmosferische wetenschappers werken samen om seismische voetafdrukken van tyfoons te volgen
Geofysici en atmosferische wetenschappers werken samen om seismische voetafdrukken van tyfoons te volgen Hoe om te gaan met ecologische en sociale uitdagingen in waterbeheer
Hoe om te gaan met ecologische en sociale uitdagingen in waterbeheer Wetenschappers onthullen oorzaken van langdurige lente-zomerdroogte boven Noord-China
Wetenschappers onthullen oorzaken van langdurige lente-zomerdroogte boven Noord-China Lage zuurstof in het bodemwater leidt tot meer organisch materiaal dat op de zeebodem terechtkomt
Lage zuurstof in het bodemwater leidt tot meer organisch materiaal dat op de zeebodem terechtkomt Welk soort ecosysteem leven tijgers?
Welk soort ecosysteem leven tijgers?
Hoofdlijnen
- Wat is het verschil tussen een gewone en een wetenschappelijke naam?
- Onderzoekers bepalen hoe groepen beslissingen nemen
- Wat is de vrouwelijke gameet?
- Dominante fysische genen in Humans
- Wat zijn feromen en hoe gebruiken insectenetende planten ze?
- Verloren of uitgestorven? Uit onderzoek blijkt dat het bestaan van meer dan 500 diersoorten onzeker blijft
- Hoe vissen tegelijkertijd geluiden horen en maken
- Wetenschappers leggen uit waarom vogels in de lente seks op de hersenen krijgen
- EU-lidstaten stemmen volgende maand over vijfjarige verlenging van onkruidverdelger
- Elektriciteit gebruiken om de hoeveelheid gegevens te vergroten die door DNA kan worden opgeslagen

- Nieuwe ontdekking van cellulose kan leiden tot nieuwe chemicaliën, biobrandstoffen
- Nieuwe materialen helpen volumetrisch 3D-printen uit te breiden

- Onderzoekers ontwikkelen geminiaturiseerde nucleaire magnetische resonantie voor olie- en gasexploratie

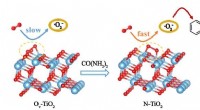
- Onderzoek naar zeer selectieve katalysatoren via fabricage van zuurstofvacatures op TiO2
 Vogels tonen een verrassende veerkracht in het licht van natuurlijke spanningen
Vogels tonen een verrassende veerkracht in het licht van natuurlijke spanningen  Honingbijen stemmen om te beslissen over nestplaatsen – waarom we zouden moeten luisteren
Honingbijen stemmen om te beslissen over nestplaatsen – waarom we zouden moeten luisteren  Onderzoekers ontwikkelen draagbare optische atoomklok
Onderzoekers ontwikkelen draagbare optische atoomklok Moe van het wachten op een ober?
Moe van het wachten op een ober? Ruimtedieren
Ruimtedieren  Mix van grafeen nanoribbons, polymeer heeft potentie voor auto's, Frisdrank, bier
Mix van grafeen nanoribbons, polymeer heeft potentie voor auto's, Frisdrank, bier Hoe verbeteren microscopen ons leven vandaag?
Hoe verbeteren microscopen ons leven vandaag?  Nieuw leven inblazen in kleurstofgevoelige zonnecellen
Nieuw leven inblazen in kleurstofgevoelige zonnecellen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

