
Wetenschap
Kunnen een kation en anion iso -elektronisch zijn uit dezelfde periode?
* iso -elektronische soorten: Iso -elektronische soorten hebben hetzelfde aantal elektronen.
* kationen en anionen: Kationen worden gevormd door elektronen te verliezen, terwijl anionen worden gevormd door elektronen te winnen.
* Periodiciteit: Elementen binnen dezelfde periode hebben hetzelfde aantal elektronenschalen, maar verschillende aantallen elektronen in hun buitenste schaal (valentie -elektronen).
Voorbeeld:
* natrium (na) , in periode 3, heeft 11 elektronen.
* Natriumkation (Na+) verliest één elektron en laat het 10 elektronen achter.
* chloor (Cl) , ook in periode 3, heeft 17 elektronen.
* chloride-anion (Cl-) krijgt één elektron, waardoor het 18 elektronen heeft.
Zoals je kunt zien, hoewel Na+ en Cl- uit dezelfde periode zijn, hebben ze verschillende aantallen elektronen en kunnen ze niet iso-elektronisch zijn.
Daarom kan een kation en anion uit dezelfde periode nooit iso -elektronisch zijn.
 Welk type experiment gaat u uitvoeren op verschillende vloeistoffen beïnvloeden de groei van de planten?
Welk type experiment gaat u uitvoeren op verschillende vloeistoffen beïnvloeden de groei van de planten?  Onderzoek naar met stikstof gedoteerde polycyclische aromatische koolwaterstoffen voor hoogwaardige OLED's
Onderzoek naar met stikstof gedoteerde polycyclische aromatische koolwaterstoffen voor hoogwaardige OLED's Welke pH -klep meet de zuurgraad?
Welke pH -klep meet de zuurgraad?  Pentaceenderivaat heeft 100 keer meer lichtbestendigheid dan conventionele producten
Pentaceenderivaat heeft 100 keer meer lichtbestendigheid dan conventionele producten Een nieuw bioproces om plantaardig materiaal om te zetten in waardevolle chemicaliën
Een nieuw bioproces om plantaardig materiaal om te zetten in waardevolle chemicaliën
 ONS, EU importeert mogelijk illegaal hout uit Brazilië:rapport
ONS, EU importeert mogelijk illegaal hout uit Brazilië:rapport Onderzoek werpt licht op altruïsme:digitale evolutietechnieken laten zien hoe soorten altruïstisch worden
Onderzoek werpt licht op altruïsme:digitale evolutietechnieken laten zien hoe soorten altruïstisch worden  Wat het kwikbesluit van de EPA betekent voor de volksgezondheid
Wat het kwikbesluit van de EPA betekent voor de volksgezondheid Studie van Europese historische gegevens suggereert dat het aandeel NO2 in de NOx-emissies kleiner is dan gedacht
Studie van Europese historische gegevens suggereert dat het aandeel NO2 in de NOx-emissies kleiner is dan gedacht Hoe kan een ecosysteem overleven?
Hoe kan een ecosysteem overleven?
Hoofdlijnen
- Hoe worden eigenschappen van ouders doorgegeven aan hun nakomelingen?
- Wat is de dubbele helix?
- Welk lichaamssysteem bevat het spijsverteringssysteem?
- Onderzoek naar de rol van methylering bij vernalisatie en fotoperiode-route:een potentiële bloeiregulator?
- Hoe transporteren dragereiwitten ADP en ATP de mitochondriën in?
- Hoe de lengte van DNA-fragmenten te berekenen
- Welke soorten moleculen kunnen door het plasmamembraan worden gevoerd door eenvoudige diffusie?
- Verstoren parasieten de voedselwebtheorie?
- Wat is organische verbinding die informatie opslaat die nodig is voor het maken van eiwitten?
- Discovery wijst de weg naar betere en goedkopere transparante geleiders
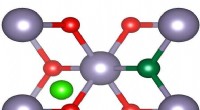
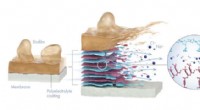
- Peel-off coating houdt ontzilting schoner en groener
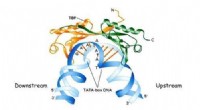
- Synthetische bedrukte polymeren herkend door DNA
- Katalytische protocellen worden zingy

- Onderzoekers ontwikkelen ultrasterke aerogels met materialen die worden gebruikt in kogelwerende vesten

 Hoe lang is Mercurius zichtbaar in een donkere hemel?
Hoe lang is Mercurius zichtbaar in een donkere hemel?  Kikkerschuim gebruiken als een antiseptisch toedieningssysteem
Kikkerschuim gebruiken als een antiseptisch toedieningssysteem Wetenschappers leggen het koude hart bloot van aan land vallende orkanen
Wetenschappers leggen het koude hart bloot van aan land vallende orkanen Afbeelding:Lancering van de Galileo-missie
Afbeelding:Lancering van de Galileo-missie Geleidende biopolymeren met gerecyclede bijproducten van de voedingsindustrie
Geleidende biopolymeren met gerecyclede bijproducten van de voedingsindustrie Hoe zien de S. thermophilus -bacteriën in yoghurt eruit?
Hoe zien de S. thermophilus -bacteriën in yoghurt eruit?  Onderzoekers rekenen vooruit op batterijopslag
Onderzoekers rekenen vooruit op batterijopslag Een voedselschip uit de Bronstijd dat 42 jaar geleden werd opgegraven tijdens een sloop in een winkelstraat, is tentoongesteld in een nabijgelegen museum
Een voedselschip uit de Bronstijd dat 42 jaar geleden werd opgegraven tijdens een sloop in een winkelstraat, is tentoongesteld in een nabijgelegen museum
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

