
Wetenschap
Waarom mixt NT -water- en olievermelding?
* Water (H₂o) is een polair molecuul: Dit betekent dat het een enigszins positief uiteinde heeft (nabij de waterstofatomen) en een enigszins negatief uiteinde (nabij het zuurstofatoom). Met deze polariteit kunnen watermoleculen sterke waterstofbruggen met elkaar vormen, waardoor een samenhangend netwerk ontstaat.
* olie (koolwaterstoffen) is een niet -polair molecuul: Koolwaterstoffen bestaan voornamelijk uit koolstof- en waterstofatomen. Deze atomen delen elektronen gelijk, wat resulteert in een evenwichtige ladingsverdeling, waardoor het molecuul niet -polair is.
* "zoals oplost zoals": Polaire stoffen zoals water hebben de neiging andere polaire stoffen op te lossen, terwijl niet -polaire stoffen zoals olie andere niet -polaire stoffen oplossen. Watermoleculen worden aangetrokken door andere polaire moleculen, terwijl oliemoleculen worden aangetrokken door andere niet -polaire moleculen.
Waarom ze niet mixen:
Wanneer water en olie in contact komen, voorkomt de sterke aantrekkingskracht tussen watermoleculen (waterstofbinding) oliemoleculen om het waternetwerk binnen te dringen. Evenzo hebben de niet -polaire oliemoleculen geen aantrekking voor de polaire watermoleculen. Dit verschil in aantrekkingskracht leidt tot scheiding in twee verschillende lagen.
in eenvoudiger termen: Stel je voor dat watermoleculen handshand vasthouden en een strakke cirkel vormen. Oliemoleculen, anders zijn, kunnen niet handen vasthouden met de watermoleculen en blijven daarom gescheiden.
Uitzonderingen:
Er zijn enkele uitzonderingen op deze regel. Bijvoorbeeld het toevoegen van een oppervlakteactieve stof (zoals zeep) kan het water- en oliemengsel helpen door te werken als een brug tussen de twee, waardoor een emulsie ontstaat.
 Kernwapensimulaties tonen de prestaties tot in moleculair detail
Kernwapensimulaties tonen de prestaties tot in moleculair detail  Interfaciale chemie verbetert de oplaadbaarheid van Zn-batterijen
Interfaciale chemie verbetert de oplaadbaarheid van Zn-batterijen Koele vlammen ontstoken in de ruimte
Koele vlammen ontstoken in de ruimte Ontsteking van het synthetische transport van aminozuren in levende cellen
Ontsteking van het synthetische transport van aminozuren in levende cellen Hoe kunnen de chemische eigenschappen van een stof worden bepaald?
Hoe kunnen de chemische eigenschappen van een stof worden bepaald?
 Onderzoekers ontdekken vulkanische warmtebron onder grote Antarctische gletsjer
Onderzoekers ontdekken vulkanische warmtebron onder grote Antarctische gletsjer Wat gebeurt er met regenwater waar het het aardoppervlak bereikt?
Wat gebeurt er met regenwater waar het het aardoppervlak bereikt?  Schud het op:door mensen veroorzaakte en natuurlijke aardbevingen in het centrum van de VS zijn inherent vergelijkbaar
Schud het op:door mensen veroorzaakte en natuurlijke aardbevingen in het centrum van de VS zijn inherent vergelijkbaar Hier komt de nieuwe generatie klimaatmodellen:De toekomst van regenval in de Alpen
Hier komt de nieuwe generatie klimaatmodellen:De toekomst van regenval in de Alpen Low-flow-onderzoek op de Colorado-rivier werpt licht op het uiteindelijke nieuwe normaal voor Grand Canyon
Low-flow-onderzoek op de Colorado-rivier werpt licht op het uiteindelijke nieuwe normaal voor Grand Canyon
Hoofdlijnen
- Wat doet vijverkruid?
- Hoe Dopamine sommige voedingsmiddelen verslavend maakt
- Nieuwe bevindingen werpen licht op hoe bella-motten gif gebruiken om partners aan te trekken
- Diffusie: wat is het? & Hoe gebeurt het?
- Nieuw onderzoek om uit te zoeken hoe microben rijstplanten beïnvloeden
- Hoe beïnvloeden milieuchemicaliën gieren?
- Het bestuderen van roofzuchtig gedrag in het bacterierijk
- Wat is Tessesive Trait?
- Is Sistotrema een saprofyt -parasiet of mutualist?
- Spinpeptiden bestrijden superbacteriën en kanker
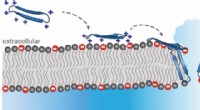
- 3D-inkten die selectief kunnen worden gewist

- Onderzoekers identificeren de oorsprong van het metabolisme
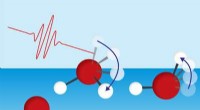
- Wateroppervlaktemoleculen verliezen energie door rotatie van vrije OH-groep
- Nieuwe legering kan het gewicht van warmteafvoersystemen direct met een derde verminderen

 Welk type organismen hebben cellen met zeer grote vacuolen?
Welk type organismen hebben cellen met zeer grote vacuolen?  Cool touch-shirts kunnen ervoor zorgen dat je je koel voelt op warme dagen, maar welke materialen werken het beste?
Cool touch-shirts kunnen ervoor zorgen dat je je koel voelt op warme dagen, maar welke materialen werken het beste? Informatie over kompassen voor kinderen
Informatie over kompassen voor kinderen  Wat zijn twee reservoirs van koolstof?
Wat zijn twee reservoirs van koolstof?  Hoe werkt een elektrische motor?
Hoe werkt een elektrische motor?  Welke geleiders verwijderen ladingen door de aarde aan te raken?
Welke geleiders verwijderen ladingen door de aarde aan te raken?  Wat is de massa van een monster zwavelzuur van 26,2 ml?
Wat is de massa van een monster zwavelzuur van 26,2 ml?  Nanodeeltjes kunnen een gevoeligere en duurzamere snelle COVID-19-test mogelijk maken
Nanodeeltjes kunnen een gevoeligere en duurzamere snelle COVID-19-test mogelijk maken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

