
Wetenschap
Monster met een gewicht van 1,5 g bleek alleen Mn en S te bevatten. Het reageerde volledig met zuurstof en produceerde 1,22 g MnIIoxide. 1,38 zwaveltrioxide. Wat is de eenvoudigste verbinding met de formule?
Stap 1:Bereken het aantal mol Mn en S in de verbinding.
- Mol Mn =(massa Mn) / (molaire massa Mn)
=(massa van Mn in het oxide - massa van Mn in het monster) / (molaire massa van Mn)
=(1,22 g - 0,5 g) / (54,94 g/mol)
=0,0134mol
- Mol van S =(massa van S) / (molaire massa van S)
=(massa van S in het oxide - massa van S in het monster) / (molaire massa van S)
=(1,38 g - 0,5 g) / (32,06 g/mol)
=0,0274mol
Stap 2:Bepaal de molverhouding van Mn en S.
- Verdeel de mollen van elk element door het kleinere aantal mol om de eenvoudigste gehele getalsverhouding te verkrijgen.
- Mn:S =0,0134 mol / 0,0134 mol:0,0274 mol / 0,0134 mol
- Mn:S =1 :2
Stap 3:Schrijf de empirische formule.
- De eenvoudigste formule van de verbinding is MnS, aangezien de molverhouding van Mn tot S 1:2 is.
 Welke ingrediënten zitten er in gif-hemlock?
Welke ingrediënten zitten er in gif-hemlock?  Röntgenstralen vergroten de eiwitstructuur in het hart van het COVID-19-virus
Röntgenstralen vergroten de eiwitstructuur in het hart van het COVID-19-virus Antilichaam-biosensor biedt onbeperkte medicatiebewaking op het punt van zorg
Antilichaam-biosensor biedt onbeperkte medicatiebewaking op het punt van zorg Grote vooruitgang in detectie van nanoporiën van peptiden en eiwitten
Grote vooruitgang in detectie van nanoporiën van peptiden en eiwitten Nieuw, zeer stabiele katalysator kan helpen water in brandstof te veranderen
Nieuw, zeer stabiele katalysator kan helpen water in brandstof te veranderen
Hoofdlijnen
- Kikkervisjes voor het avondeten? Inheemse gemeenschap in Mexico onthult een favoriet recept voor een bepaalde kikker
- Wat de kleinste infectieuze agentia onthullen over evolutie
- Onderzoek levert inzicht op in hoe plantencellen groeien
- Biologen onthullen hoe obesitas het skeletspiermetabolisme schaadt
- Studie meldt eerste bewijs van sociale relaties tussen chimpansees en gorilla's
- Onderzoek werpt licht op hoe zeedieren stress overleven
- Waarom zoeken niet meer minderheidsstudenten een STEM-carrière? Vraag het ze
- Onderzoek naar een moleculair mechanisme dat thermofiele schimmelaanpassing aan temperatuurverandering vergemakkelijkt
- Kiemcellen bewegen als kleine bulldozers
- AI zocht naar single-atom-alloy katalysatoren, 200 veelbelovende kandidaten gevonden
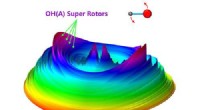
- Laser onthult elektronisch geëxciteerde hydroxyl-superrotors in waterfotochemie
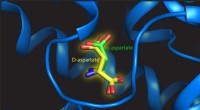
- Een rechterhand in een linkshandige want passen
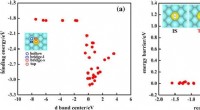
- Een stabiliserende invloed maakt de evolutie van lithium-zwavelbatterijen mogelijk
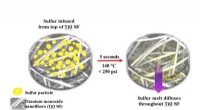
- Kan deze invasieve exotische plaag betere materialen maken voor de industrie en de geneeskunde?

 Hoe CAT-scans werken
Hoe CAT-scans werken  Als auto 1 een grotere traagheid heeft dan auto 2, dan heeft dat?
Als auto 1 een grotere traagheid heeft dan auto 2, dan heeft dat?  Clingfish-biologie inspireert betere zuignap
Clingfish-biologie inspireert betere zuignap Werkt de zwaartekracht op stofdeeltjes?
Werkt de zwaartekracht op stofdeeltjes?  Metamaterialen met nulindex en de toekomst
Metamaterialen met nulindex en de toekomst  Hoe kinesiotape werkt
Hoe kinesiotape werkt  Wat zijn twee voorbeelden van chemische energie die in een andere vorm wordt omgezet?
Wat zijn twee voorbeelden van chemische energie die in een andere vorm wordt omgezet?  Wat is een zuur plus een carbonaat?
Wat is een zuur plus een carbonaat?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

