
Wetenschap
Waarom worden evenwichtspijlen gebruikt in de ionisatievergelijkingen voor sommige zuren?
De evenwichtspijlen worden voor sommige zuren in de ionisatievergelijkingen gebruikt, omdat de ionisatie van zuren een omkeerbaar proces is. Dit betekent dat het zuur zowel een proton (H+) kan doneren om een hydroniumion (H3O+) te vormen als een proton van een watermolecuul kan accepteren om de geconjugeerde base te vormen. De positie van het evenwicht tussen het zuur en zijn geconjugeerde base hangt af van de sterkte van het zuur.
 Wetenschappers identificeren moleculen die cellen hadden kunnen helpen om te overleven - en te gedijen - op de vroege aarde
Wetenschappers identificeren moleculen die cellen hadden kunnen helpen om te overleven - en te gedijen - op de vroege aarde Hoe verklaar je hoe zuurstof in je bloed komt?
Hoe verklaar je hoe zuurstof in je bloed komt?  Nieuwe zeer selectieve antitumor fotodynamische therapiemiddelen gesynthetiseerd
Nieuwe zeer selectieve antitumor fotodynamische therapiemiddelen gesynthetiseerd Waar is indium van gemaakt?
Waar is indium van gemaakt?  E-nose kan verschillende muntgeuren onderscheiden
E-nose kan verschillende muntgeuren onderscheiden
Hoofdlijnen
- Biologen werpen licht op het mysterie van hoe microben evolueren en hun gastheren beïnvloeden
- Functie van de witte bloedcellen?
- Waar worden geslachtscellen bij mensen geproduceerd?
- Het belang van plantaardige cellen
- Brandstof voor de toekomst:wetenschappers promoten nieuwe methode voor de productie van algenwaterstof
- Waar bevinden zich delen van het chloroplast-ATP-synthase die betrokken zijn bij de fosforylering van ADP naar ATP?
- Kunnen we de taal van onze neven en nichten van primaten decoderen?
- Oorsprong van het leven? Ontdekking zou kunnen helpen verklaren hoe de eerste organismen op aarde ontstonden
- Hoe brassinosteroïde-signalering ervoor zorgt dat wortels langer groeien bij stikstofgebrek
- Nieuwe synthesemethode levert afbreekbare polymeren op

- Cryo-EM onthult kroonachtige structuur van eiwit dat verantwoordelijk is voor het reguleren van de bloedstroom
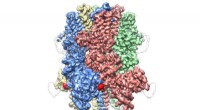
- Wetenschappers vinden nieuw sensing-oogmasker uit

- Laat de europium helderder schijnen

- Gestroomlijnd proces opent de ontwikkeling van geneesmiddelen voor een nieuwe klasse steroïden
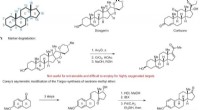
 Hoe Candida albicans zuurstofgebrek exploiteert om ziekten te veroorzaken
Hoe Candida albicans zuurstofgebrek exploiteert om ziekten te veroorzaken  De zwaarste schildpad ter wereld? Overlevende van 8 keert terug naar oceaan
De zwaarste schildpad ter wereld? Overlevende van 8 keert terug naar oceaan Consciëntieusheid sleutel tot teamsucces tijdens ruimtemissies
Consciëntieusheid sleutel tot teamsucces tijdens ruimtemissies Neutrino's leveren het eerste experimentele bewijs op van gekatalyseerde fusie die dominant is in veel sterren
Neutrino's leveren het eerste experimentele bewijs op van gekatalyseerde fusie die dominant is in veel sterren Open gerefereerde paper onthult hoe onstabiele radioactieve kernen dubbele eigenschappen kunnen worden bestudeerd
Open gerefereerde paper onthult hoe onstabiele radioactieve kernen dubbele eigenschappen kunnen worden bestudeerd Een onderzoek laat zien hoe ademhalingsbuizen en haarvaten ontstaan
Een onderzoek laat zien hoe ademhalingsbuizen en haarvaten ontstaan  Onbreekbare kwantumverstrengeling
Onbreekbare kwantumverstrengeling Onderzoekers brengen een revolutie teweeg in 3D-geprinte producten met een datagestuurde ontwerpmethode
Onderzoekers brengen een revolutie teweeg in 3D-geprinte producten met een datagestuurde ontwerpmethode
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

