
Wetenschap
5,012 g oxaalzuurhydraat wordt opgelost in voldoende water om 100 ml oplossing te maken. deze oplossing gestitreerd met een gestandaardiseerde NaOH. Het vereiste 39,40 2,02 M om de?
$$H_2C_2O_4 \cdot 2H_2O_{(aq)} + 2NaOH_{(aq)} \rightarrow Na_2C_2O_4_{(aq)} + 4H_2O_{(l)}$$
Molen NaOH gebruikt:
$$Moles \ van \ NaOH =Concentratie \maal Volume$$
$$Mollen \ van \ NaOH =2,02 \ M \ maal 39,40 \ ml =79,668 \ maal 10^{-3} \ mol$$
Molen oxaalzuurhydraat:
$$Moles \ of \ H_2C_2O_4 \cdot 2H_2O =\frac{Mass}{Molar \ Mass}$$
$$Moles \ van \ H_2C_2O_4 \cdot 2H_2O =\frac{5,012 \ g}{126,07 \ g/mol} =39,755\times10^{-3} \ mol$$
Verhouding van moedervlekken:
Uit de uitgebalanceerde chemische vergelijking kunnen we zien dat 1 mol oxaalzuurhydraat reageert met 2 mol NaOH. Daarom is de verhouding van het aantal mol 1:2.
$$\frac{Molen \ van \ H_2C_2O_4 \cdot 2H_2O}{Molen \ van \ NaOH} =\frac{39,755\times10^{-3} \ mol}{79,668\times10^{-3} \ mol} =0,5 $$
Omdat de verhouding niet 1:2 is, geeft dit aan dat niet al het oxaalzuurhydraat heeft gereageerd. Er kunnen nog andere factoren zijn die de titratie beïnvloeden, zoals de aanwezigheid van onzuiverheden of een onvolledige reactie.
 Chiton-weekdier biedt model voor nieuw pantserontwerp
Chiton-weekdier biedt model voor nieuw pantserontwerp Wat zit er achter de giftige niveaus van kwik bij tropische vogels? Goudwinning, studieshows
Wat zit er achter de giftige niveaus van kwik bij tropische vogels? Goudwinning, studieshows  Hoe beïnvloedt het verhogen van de concentratie kaliumjodide en zwavelzuur de reactiesnelheid?
Hoe beïnvloedt het verhogen van de concentratie kaliumjodide en zwavelzuur de reactiesnelheid?  Waar studeren scheikundigen?
Waar studeren scheikundigen?  Eigenschappen van CO2-clathraathydraat
Eigenschappen van CO2-clathraathydraat
Hoofdlijnen
- Nieuwe studie werpt licht op hoe intracellulaire pathogenen het immuunsysteem activeren
- Hoe de genoomdiversiteit van belangrijke gewassen hun evolutie vertelt
- Onderzoek wijst achteruitgang van arctische kustvogels aan
- Nieuwe high-throughput sequencing-technologieën onthullen een wereld van op elkaar inwerkende micro-organismen
- Onderzoekers willen weten waarom beluga-walvissen zich niet hebben hersteld
- Doorbraak in genetisch onderzoek om gerstproductie te stimuleren
- Uit onderzoek blijkt hoe twee stammen van één bacterie samen een vleesetende infectie veroorzaken
- Chimpansees in gevangenschap vertonen tekenen van een aangetaste geestelijke gezondheid
- Maken regenachtige dagen je echt down?
- Onderzoekers lossen een 50 jaar oud enzymmysterie op
- Nieuwe methode maakt grootschalige productie van biobased plastic flessen mogelijk
- Hittegeharde magnesiumlegering een sterke keuze voor implantaten
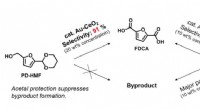
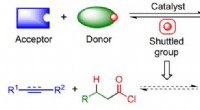
- Voorlopers van zuurchloride maken met behulp van shuttle-katalyse
- Mechanisme van remming van schorpioentoxine van K+-kanaal opgehelderd met behulp van snelle AFM
 Een onderzoek roept vragen op over het gebruik van dronebeelden voor omgevingsmonitoring
Een onderzoek roept vragen op over het gebruik van dronebeelden voor omgevingsmonitoring Heeft een Engelse wetenschapper het eerste periodiek systeem der elementen gemaakt?
Heeft een Engelse wetenschapper het eerste periodiek systeem der elementen gemaakt?  Het hardnekkige hogedruksysteem achter de recordhittegolven in Australië
Het hardnekkige hogedruksysteem achter de recordhittegolven in Australië Waarom is de landbouw geëvolueerd?
Waarom is de landbouw geëvolueerd?  Wat zijn meteoren van?
Wat zijn meteoren van?  Meerpuntstemperatuurmetingen in gepakte bedden met behulp van fosforthermometrie en ray tracing-simulaties
Meerpuntstemperatuurmetingen in gepakte bedden met behulp van fosforthermometrie en ray tracing-simulaties  SpaceX streeft naar 3e lanceringsuur van de bemanning voor zonsopgang op vrijdag
SpaceX streeft naar 3e lanceringsuur van de bemanning voor zonsopgang op vrijdag Wat is het ruwe endoplasmatisch reticulum?
Wat is het ruwe endoplasmatisch reticulum?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

