
Wetenschap
een bepaald koolhydraat bevat drie elementen koolstof, waterstof en zuurstof. de verbranding van 59,5 g monster produceert 103,9 co2 8,50 h2o wat is de empirische formule?
1. Converteer de gegeven massa's CO2 en H2O naar mol.
- Mol CO2 =103,9 g / 44,01 g/mol =2,36 mol
- Mol H2O =8,50 g / 18,02 g/mol =0,472 mol
2. Bepaal het aantal mol koolstof en waterstof in het monster.
- Mol C =Mol CO2 =2,36 mol
- Mol H =2 x Mol H2O =2 x 0,472 mol =0,944 mol
3. Neem aan dat de totale massa van het monster 59,5 g bedraagt, wat de som vertegenwoordigt van de massa's koolstof, waterstof en zuurstof.
- Massa zuurstof =Totale massa - (massa koolstof + massa waterstof)
- Zuurstofmassa =59,5 g - (2,36 mol x 12,01 g/mol + 0,944 mol x 1,01 g/mol)
- Zuurstofmassa =59,5 g - (28,36 g + 0,952 g)
- Zuurstofmassa =59,5 g - 29,312 g
- Zuurstofmassa =30,188 g
4. Converteer de massa's koolstof, waterstof en zuurstof naar mol.
- Mol C =2,36 mol
- Mol H =0,944 mol
- Mol O =30,188 g / 16,00 g/mol =1,887 mol
5. Verdeel de mollen van elk element door het kleinste aantal mol om de eenvoudigste molverhouding te verkrijgen.
- Mol C / 1,887 mol =2,36 mol / 1,887 mol ≈ 1,25
- Mol H / 1,887 mol =0,944 mol / 1,887 mol ≈ 0,5
- Mol O / 1,887 mol =1,887 mol / 1,887 mol =1
6. Vermenigvuldig de molverhoudingen met een geschikte factor om hele getallen te verkrijgen. In dit geval geeft vermenigvuldigen met 2:
- Mol C ≈ 2,5
- Mollen van H ≈ 1
- Mol O ≈ 2
Daarom is de empirische formule van het koolhydraat ongeveer C2.5H1O2.
 Nieuw scheidingsproces voor belangrijk radiodiagnostisch middel vermindert radioactief afval
Nieuw scheidingsproces voor belangrijk radiodiagnostisch middel vermindert radioactief afval Waarom wordt koper gebruikt om sieraden te maken?
Waarom wordt koper gebruikt om sieraden te maken?  Wat wordt er gevormd als 2 glucosemoleculen worden gecombineerd?
Wat wordt er gevormd als 2 glucosemoleculen worden gecombineerd?  Nieuwe routes voor de constructie van sterke metaal-ondersteuningsinteracties
Nieuwe routes voor de constructie van sterke metaal-ondersteuningsinteracties Wat blijft er over als je verdund zwavelzuur verdampt?
Wat blijft er over als je verdund zwavelzuur verdampt?
 EU lanceert leningplan van miljard euro voor jonge boeren
EU lanceert leningplan van miljard euro voor jonge boeren Onderzoek toont een fundamenteel verschil aan tussen de manier waarop insecten en zoogdieren geuren detecteren
Onderzoek toont een fundamenteel verschil aan tussen de manier waarop insecten en zoogdieren geuren detecteren  De hitte van de mantel kan de aardkorst 3 miljard jaar geleden een impuls hebben gegeven
De hitte van de mantel kan de aardkorst 3 miljard jaar geleden een impuls hebben gegeven  China zegt dat er geen grote olieramp is na aanvaring met tanker Iran
China zegt dat er geen grote olieramp is na aanvaring met tanker Iran What Do Baby Groundhogs Eat?
What Do Baby Groundhogs Eat?
Hoofdlijnen
- Hoe onderzoekers naar het vogelbrein in actie kijken
- Gaan we de zesde grote uitsterving op aarde in?
- Intelligente microscopen voor het detecteren van zeldzame biologische gebeurtenissen
- Welk organel in plantencellen zorgt ervoor dat ze voedsel kunnen maken?
- "What Does Heterozygous Mean?
- Wat de kleinste infectieuze agentia onthullen over evolutie
- Hoe een plant zijn groei reguleert
- Zijn de hersenen los van het skelet?
- Waarom vallen orka’s bruinvissen lastig en doden ze ze zonder ze op te eten?
- Cerium zet zilver buitenspel om drugsprecursor te maken

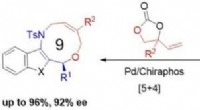
- Synthese van middelgrote ringstructuren
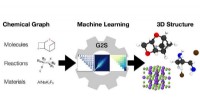
- Van chemische grafieken tot structuren
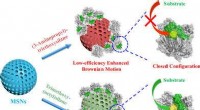
- Enzymconformatie beïnvloedt de prestaties van lipase-aangedreven nanomotoren
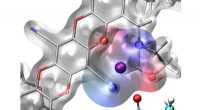
- Ontwerpen van selectieve membranen voor batterijen met behulp van een toolbox voor het ontdekken van medicijnen
 Wat zijn getijdentafels?
Wat zijn getijdentafels?  Het AI-model vergelijkt rechtstreeks de eigenschappen van potentiële nieuwe medicijnen
Het AI-model vergelijkt rechtstreeks de eigenschappen van potentiële nieuwe medicijnen  Kijken zeelieden echt naar rode luchten?
Kijken zeelieden echt naar rode luchten?  Smthg gr8 4 ontbijt? Twitter's hyperkorte recepten
Smthg gr8 4 ontbijt? Twitter's hyperkorte recepten  Math Madness: Basketbalstatistieken gebruiken in wiskundevragen voor studenten
Math Madness: Basketbalstatistieken gebruiken in wiskundevragen voor studenten Nanobellen-gecontroleerd nanofluïdisch transport
Nanobellen-gecontroleerd nanofluïdisch transport Death Valley vestigt voorlopig wereldrecord voor warmste maand (update)
Death Valley vestigt voorlopig wereldrecord voor warmste maand (update) Hoe het volume van een halve cirkel te vinden
Hoe het volume van een halve cirkel te vinden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

