
Wetenschap
Waarom is natriumhydroxide een sterkere base dan ammoniak?
1. Dissociatie in water:
Wanneer NaOH oplost in water, ondergaat het een volledige dissociatie, wat betekent dat alle natrium- (Na+) en hydroxide- (OH-) ionen worden gescheiden. De dissociatievergelijking is:
NaOH(aq) → Na+(aq) + OH-(aq)
Daarentegen ondergaat ammoniak een onvolledige dissociatie in water. Slechts een klein percentage NH3-moleculen reageert met water en vormt ammonium- (NH4+) en hydroxide-ionen (OH-). De dissociatievergelijking is:
NH3(aq) + H2O(l) ⇌ NH4+(aq) + OH-(aq)
De mate van dissociatie, ook wel de dissociatieconstante (Kb) genoemd, is voor NH3 veel lager dan voor NaOH. Dit betekent dat NaOH een hogere concentratie hydroxide-ionen in water produceert, waardoor het een sterkere base wordt.
2. Ionisch karakter:
Natriumhydroxide is een ionische verbinding, bestaande uit positief geladen natriumionen (Na+) en negatief geladen hydroxide-ionen (OH-). De sterke elektrostatische aantrekkingskracht tussen deze tegengesteld geladen ionen stabiliseert de verbinding. Ammoniak is daarentegen een covalent molecuul, waarbij stikstof- en waterstofatomen elektronen delen om een stabiele structuur te vormen.
3. Hydratie-energie:
Wanneer uit NaOH hydroxide-ionen (OH-) worden gevormd, worden ze omgeven door watermoleculen, die hydratatie-energie vrijgeven. Deze vrijkomende energie stabiliseert de hydroxide-ionen, waardoor het minder waarschijnlijk is dat ze recombineren met waterstofionen (H+) en watermoleculen hervormen. Daarentegen is de hydratatie-energie van ammoniumionen (NH4+) lager, waardoor NH3 minder profiteert van deze stabiliserende werking.
4. Conjugaatzuursterkte:
De sterkte van een base kan ook worden begrepen in termen van het geconjugeerde zuur ervan. Het geconjugeerde zuur van een base is de soort die wordt gevormd wanneer de base een proton accepteert. In het geval van NaOH is het geconjugeerde zuur water (H2O), wat een zeer zwak zuur is. Dit betekent dat NaOH effectiever is in het verwijderen van protonen uit andere moleculen, waardoor het een sterkere base wordt. Het geconjugeerde zuur van NH3 is daarentegen ammoniumion (NH4+), wat een sterker zuur is vergeleken met water. Dit geeft aan dat NH3 minder effectief is in het verwijderen van protonen, waardoor de basiciteit ervan afneemt.
Samenvattend is natriumhydroxide (NaOH) een sterkere base dan ammoniak (NH3) omdat het een vollediger dissociatie in water ondergaat, een hoger ionisch karakter heeft, meer profiteert van hydratatie-energie en een zwakker conjugaatzuur heeft. Deze factoren dragen ertoe bij dat NaOH effectiever is in het accepteren van protonen en het produceren van hydroxide-ionen, waardoor het een sterkere base wordt.
 De invloed van magnetische velden op dunnefilmstructuren
De invloed van magnetische velden op dunnefilmstructuren Hoe schadelijk zijn nano-koper en antischimmelcombinaties in de waterlopen?
Hoe schadelijk zijn nano-koper en antischimmelcombinaties in de waterlopen? Wat zijn enkele problemen met het vergassingsproces?
Wat zijn enkele problemen met het vergassingsproces?  Onderzoekers ontdekken supergeleider met onverwachte roosterconfiguratie
Onderzoekers ontdekken supergeleider met onverwachte roosterconfiguratie Waarom wordt zwavelzuur niet gebruikt om koolstofdioxide te bereiden?
Waarom wordt zwavelzuur niet gebruikt om koolstofdioxide te bereiden?
 Door klimaat veroorzaakte bodemveranderingen kunnen meer erosie en plotselinge overstromingen veroorzaken
Door klimaat veroorzaakte bodemveranderingen kunnen meer erosie en plotselinge overstromingen veroorzaken Landkaarten van Europa vanuit de cloud
Landkaarten van Europa vanuit de cloud Het is tijd voor staten die rijk werden van olie, gas en kolen om erachter te komen wat de toekomst biedt
Het is tijd voor staten die rijk werden van olie, gas en kolen om erachter te komen wat de toekomst biedt Luisteren naar micro-aardbevingen, mega-walvissen horen in het noordpoolgebied
Luisteren naar micro-aardbevingen, mega-walvissen horen in het noordpoolgebied Drie vragen die klimaatwetenschap moet beantwoorden
Drie vragen die klimaatwetenschap moet beantwoorden
Hoofdlijnen
- Hoe je een groeiende bevolking gezond voedsel kunt geven zonder de planeet te ruïneren
- Het huidige begrip van dierenwelzijn sluit momenteel vissen uit, ook al voelen vissen pijn
- Waarom haat Europa genetisch gemodificeerd voedsel en staat het op het punt van gedachten te veranderen?
- Er worden meer koeien getest en gevolgd op vogelgriep. Dit is wat dat betekent
- Fossil vangt zeesterren die zichzelf in tweeën splitsen – wat aantoont dat dit al 155 miljoen jaar gebeurt
- Waarom zijn de nakomelingen van oudere moeders minder geschikt om lang en voorspoedig te leven?
- De functie van macromoleculen
- Wat is een bioom en wat zijn de belangrijkste factoren die het type in een deelwereld bepalen?
- Hoe verstoppen bacteriën medische apparaten? Zeer snel
- Ontdekking van geheel nieuwe klasse RNA-caps in bacteriën
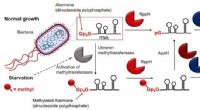
- Kneusbare kunsthuid kan helpen bij protheses, robots voelen verwondingen
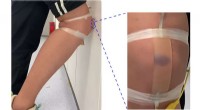
- Database voor stegananalyse van forensisch bewijs

- Nieuwe methode van warmtegeleiding kan een game changer zijn voor serverparken en vliegtuigen

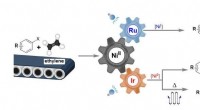
- Katalytische transformatie van ethyleen
 Het multiversum temmen - Stephen Hawkings laatste theorie over de oerknal
Het multiversum temmen - Stephen Hawkings laatste theorie over de oerknal Wat zijn de reacties van zoutzuur met methyloranje?
Wat zijn de reacties van zoutzuur met methyloranje?  Is het element silicium kneedbaar?
Is het element silicium kneedbaar?  Waar komt meiose voor bij dieren?
Waar komt meiose voor bij dieren?  Om klimaatverandering tegen te gaan, we moeten Amerikaanse bossen beschermen en uitbreiden
Om klimaatverandering tegen te gaan, we moeten Amerikaanse bossen beschermen en uitbreiden Ons klimaat is veranderd. Hoe leren we leven met extreme gebeurtenissen?
Ons klimaat is veranderd. Hoe leren we leven met extreme gebeurtenissen? De nadelen van non-ferro metalen
De nadelen van non-ferro metalen Studie documenteert de vertraging van de Atlantische stroming
Studie documenteert de vertraging van de Atlantische stroming
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

