
Wetenschap
Begrijpen hoe elektronen chemische reacties aansturen
1. Valentie-elektronen:Bij chemische reacties zijn voornamelijk de buitenste elektronen van atomen betrokken, ook wel valentie-elektronen genoemd. Deze elektronen worden losjes vastgehouden en zijn verantwoordelijk voor het vormen van chemische bindingen. De rangschikking en het gedrag van valentie-elektronen bepalen de reactiviteit van een atoom en de neiging ervan om elektronen te winnen of te verliezen.
2. Elektronegativiteit:Elektronegativiteit is de maatstaf voor het vermogen van een atoom om elektronen naar zichzelf toe te trekken. Atomen met een hoge elektronegativiteit hebben de neiging elektronen weg te trekken van naburige atomen, waardoor een onbalans in de elektronenverdeling ontstaat. Dit verschil in elektronegativiteit tussen atomen stimuleert de vorming van chemische bindingen.
3. Ionische binding:Bij ionische binding worden elektronen volledig van het ene atoom naar het andere overgedragen, wat resulteert in de vorming van positief geladen ionen (kationen) en negatief geladen ionen (anionen). De aantrekkingskracht tussen tegengesteld geladen ionen houdt de ionische verbinding bij elkaar.
4. Covalente binding:Covalente binding vindt plaats wanneer atomen elektronen delen om een stabiele elektronenconfiguratie te bereiken. Bij dit type binding worden elektronen niet overgedragen, maar gedeeld tussen atomen, waardoor een covalente binding ontstaat. Het delen van elektronen leidt tot de vorming van moleculen.
5. Afstoting van elektronenparen:De elektronen in een molecuul ervaren afstoting vanwege hun negatieve ladingen. Deze afstoting beïnvloedt de moleculaire geometrie en vorm. De rangschikking van elektronen rond atomen bepaalt de hoeken tussen bindingen en de algehele moleculaire structuur.
6. Oxidatie-reductiereacties:Bij chemische reacties gaat het vaak om de overdracht van elektronen tussen atomen of moleculen. Oxidatie is het verlies van elektronen, terwijl reductie de winst van elektronen is. Deze reacties vinden gelijktijdig plaats, waarbij de ene soort wordt geoxideerd en de andere wordt gereduceerd. Redoxreacties zijn essentieel bij veel biologische processen, zoals cellulaire ademhaling en fotosynthese.
7. Energieniveaus en kwantummechanica:Het gedrag van elektronen in chemische reacties kan worden begrepen via de kwantummechanica. Elektronen bezetten specifieke energieniveaus binnen een atoom of molecuul, en hun beweging tussen deze niveaus wordt geassocieerd met de absorptie of het vrijkomen van energie. De kwantummechanica biedt het theoretische raamwerk voor het begrijpen van elektronengedrag en de energie van chemische reacties.
Door te begrijpen hoe elektronen chemische reacties aansturen, kunnen wetenschappers het gedrag van stoffen voorspellen en verklaren, nieuwe materialen ontwerpen en innovatieve technologieën ontwikkelen. De studie van elektronengedrag is van cruciaal belang voor het vergroten van onze kennis op het gebied van scheikunde, natuurkunde, biologie en andere aanverwante gebieden, en geeft vorm aan ons begrip van de fundamentele processen die onze wereld beheersen.
 Mechanisme van remming van schorpioentoxine van K+-kanaal opgehelderd met behulp van snelle AFM
Mechanisme van remming van schorpioentoxine van K+-kanaal opgehelderd met behulp van snelle AFM Hoe vormen polaire moleculen waterstofbindingen?
Hoe vormen polaire moleculen waterstofbindingen?  Nobelprijs voor scheikunde eert groenere manier om moleculen te bouwen
Nobelprijs voor scheikunde eert groenere manier om moleculen te bouwen Nieuwe functionele biochar-composieten helpen afvalwater te behandelen
Nieuwe functionele biochar-composieten helpen afvalwater te behandelen Verbetering van de efficiëntie van de ionentransmissie van massaspectrometers
Verbetering van de efficiëntie van de ionentransmissie van massaspectrometers
 Waardoor worden woestijnen gevormd?
Waardoor worden woestijnen gevormd?  Wilt u milieuvriendelijk gedrag stimuleren? Geef consumenten een duwtje in de rug (vertel ze niet wat ze moeten doen)
Wilt u milieuvriendelijk gedrag stimuleren? Geef consumenten een duwtje in de rug (vertel ze niet wat ze moeten doen)  Gladde redding:kan zeewier als koeienvoer het klimaat helpen?
Gladde redding:kan zeewier als koeienvoer het klimaat helpen?  Tropische onweersbuien zullen sterker worden naarmate de wereld warmer wordt
Tropische onweersbuien zullen sterker worden naarmate de wereld warmer wordt Winnaars van klimaatverandering zijn mogelijk financiële compensatie verschuldigd aan vervuilers
Winnaars van klimaatverandering zijn mogelijk financiële compensatie verschuldigd aan vervuilers
Hoofdlijnen
- Waarom dassen ten onrechte worden gedemoniseerd en wat we kunnen doen om te helpen
- Onderzoekers ontwikkelen een genetische aanpak voor plantenregeneratie zonder de toepassing van fytohormonen
- Onderzoekers identificeren combinatie van factoren voor biologische cacaoopbrengst
- Hoe Facebook kraakt over nepnieuws (en waarom nepnieuws werkt)
- Hoe orgaanfuncties in de loop van de evolutie werden gevormd
- Nieuw model bevestigt dat bedreigde rechtse walvissen afnemen
- Onderzoekers onderzoeken hoe de persoonlijkheid van een CEO de bedrijfscultuur beïnvloedt
- Unieke pigmenten in de fotosynthetische mariene bacterie onthullen hoe hij leeft bij weinig licht
- Vleermuizen en insecten vechten in de tropen
- Australische struik bevat nieuwe klasse organische verbindingen
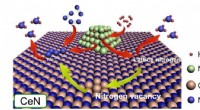
- De leegte in de ammoniaksynthese vullen:de rol van stikstofvacatures in katalysatoren
- Moleculaire sonde brengt verkeerd gevouwen proteoomstatus in levende cellen in kaart
- Het verwijderen van giftig kwik uit verontreinigd water

- Biofysici richten zich op het mechanisme dat het Zika-virus zo gevaarlijk maakt
 Een ontwerpstrategie om stabiele en energierijke waterige zink-mangaandioxidebatterijen te produceren
Een ontwerpstrategie om stabiele en energierijke waterige zink-mangaandioxidebatterijen te produceren Easy High School Physics Experiments
Easy High School Physics Experiments  Enzymonderzoek onthult waarom sommige kankermedicijnen ernstige bijwerkingen veroorzaken
Enzymonderzoek onthult waarom sommige kankermedicijnen ernstige bijwerkingen veroorzaken  Uit gegevens blijkt dat het begraven van organische koolstof met behulp van klei een vroege Paleozoïsche atmosferische oxygenatie veroorzaakte
Uit gegevens blijkt dat het begraven van organische koolstof met behulp van klei een vroege Paleozoïsche atmosferische oxygenatie veroorzaakte  Black Lives Matter in Europa:wat blijft er over van de beweging?
Black Lives Matter in Europa:wat blijft er over van de beweging? 3D Grassland School Projects
3D Grassland School Projects Wetenschappers ontwikkelen technologie voor waterzuivering door elektrische ontladingen
Wetenschappers ontwikkelen technologie voor waterzuivering door elektrische ontladingen Onderzoekers vinden cicadevleugelstructuur die bacteriën kan doden bij contact (met video)
Onderzoekers vinden cicadevleugelstructuur die bacteriën kan doden bij contact (met video)
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

