
Wetenschap
Wat gebeurt er als je een chemische binding laat exploderen?
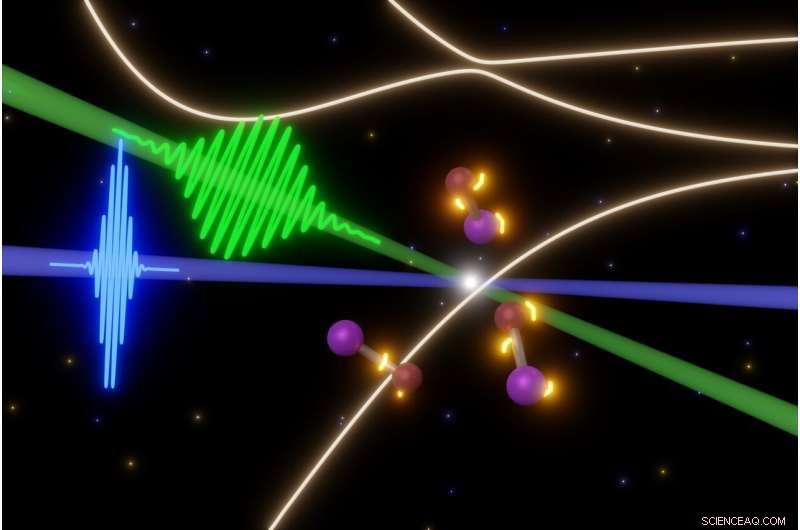
Wetenschappers van UC Berkeley onderzoeken de vluchtige stappen in snelle fotochemische reacties met enkele van de kortste laserpulsen die tegenwoordig mogelijk zijn. In dit geval, een femtoseconde puls van zichtbaar licht (groen) veroorzaakt het uiteenvallen van jodiummonobromide-moleculen (midden), terwijl attoseconde XUV-laserpulsen (blauw) snapshots van de moleculen maken. Zo kunnen ze een filmpje maken van de evolutie van elektronische toestanden (gele lichten rond moleculen) voordat de moleculen uiteenspatten. Krediet:Yuki Kobayashi, UC Berkeley
Op heldere zomerdagen, het zonlicht overal om ons heen breekt slecht door bindingen te verbreken. Chemische bindingen.
Ultraviolet licht verbreekt de verbindingen tussen atomen in het DNA van onze huidcellen, mogelijk kanker veroorzaken. UV-licht verbreekt ook zuurstofbindingen, uiteindelijk het creëren van ozon, en splitst waterstof van andere moleculen om vrije radicalen achter te laten die weefsel kunnen beschadigen.
Universiteit van Californië, Berkeley, scheikundigen die enkele van de kortste beschikbare laserpulsen gebruiken - een triljoenste van een seconde - zijn nu in staat om het stapsgewijze proces op te lossen dat leidt tot het exploderen van een chemische binding, in wezen het maken van een film van het evenement. Ze kunnen elektronen volgen die besluiteloos rondstuiteren in verschillende toestanden in het molecuul voordat de binding verbreekt, en de atomen gaan hun eigen weg.
De techniek, meldde vorige week in het journaal Wetenschap , zal scheikundigen helpen bij het begrijpen en mogelijk manipuleren van chemische reacties die worden gestimuleerd door licht, zogenaamde fotochemische reacties. Chemici en biologen, vooral, geïnteresseerd zijn in het begrijpen hoe grote moleculen erin slagen om lichtenergie te absorberen zonder bindingen te verbreken, zoals gebeurt wanneer moleculen in het oog licht absorberen, ons visie geven, of moleculen in planten absorberen licht voor fotosynthese.
"Denk aan een molecuul, rodopsine, in het oog, " zei eerste auteur Yuki Kobayashi, een UC Berkeley-promovendus. "Als licht het netvlies raakt, rodopsine absorbeert het zichtbare licht, en we kunnen dingen zien omdat de conformatie van rhodopsin's binding verandert."
In feite, wanneer de lichtenergie wordt geabsorbeerd, een binding in rodopsine wendingen, in plaats van pauzes, andere reacties teweegbrengen die resulteren in de waarneming van licht. De techniek Kobayashi en zijn collega's van UC Berkeley, professoren Stephen Leone en Daniel Neumark, ontwikkeld, zou kunnen worden gebruikt om in detail te bestuderen hoe deze lichtabsorptie leidt tot verdraaiing nadat het molecuul door een aangeslagen toestand is gegaan die een vermeden kruising of conische kruising wordt genoemd.
Om het verbreken van een binding in het DNA te voorkomen, "je wilt de energie omleiden van dissociatie naar gewoon vibrerend heet zijn. Voor rodopsine, je de energie van vibratie wilt omleiden naar een cis-trans isomerisatie, een draai, " zei Kobayashi. "Deze omleidingen van chemische reacties vinden overal om ons heen plaats, maar we hebben het werkelijke moment van hen niet eerder gezien."

Yuki Kobayashi maakt aanpassingen aan een experiment in de kelder van Hildebrand Hall. Hij en onderzoekers in de laboratoria van Stephen Leone en Daniel Neumark richten zich op moleculen in een vacuümkamer met zowel femtoseconde als attoseconde lasers om erachter te komen hoe moleculen licht absorberen. Credit:UC Berkeley foto met dank aan Robert Sanders
Snelle laserpulsen
Attoseconde-lasers - een attoseconde is een miljardste van een miljardste van een seconde - bestaan al ongeveer tien jaar en worden door wetenschappers gebruikt om zeer snelle reacties te onderzoeken. Omdat de meeste chemische reacties snel verlopen, deze snelle-pulslasers zijn essentieel om te "zien" hoe de elektronen die de chemische binding vormen zich gedragen wanneer de binding verbreekt en/of opnieuw wordt gevormd.
Leon, hoogleraar scheikunde en natuurkunde, is een experimentator die ook theoretische hulpmiddelen gebruikt en een pionier is in het gebruik van attoseconde lasers om chemische reacties te onderzoeken. Hij heeft zes van deze röntgenstraling en extreem ultraviolet (gezamenlijk, XUV) lasers in zijn UC Berkeley laboratorium.
Werken met een van de eenvoudigste moleculen, jodiummonobromide (IBr) - wat één jodiumatoom is gekoppeld aan één broomatoom - het UC Berkeley-team raakte de moleculen met een 8 femtoseconde puls van zichtbaar licht om een van hun buitenste elektronen te exciteren, onderzocht ze vervolgens met attoseconde laserpulsen.
De attoseconde XUV-laser pulseren met intervallen van 1,5 femtoseconde (een femtoseconde is 1, 000 attoseconden), net als het gebruik van een stroboscoop, de onderzoekers konden de stappen detecteren die leidden tot het uiteenvallen van de moleculen. De hoogenergetische XUV-laser was in staat om de geëxciteerde energietoestanden te onderzoeken ten opzichte van de binnenste elektronen van het molecuul, die normaal gesproken niet deelnemen aan chemische reacties.
"Je maakt een soort film van de paden van het elektron wanneer het de kruising nadert en de waarschijnlijkheid dat het langs het ene pad of langs het andere gaat, Leone zei. "Met deze tools die we aan het ontwikkelen zijn, kun je naar vaste stoffen kijken, gassen en vloeistoffen, maar je hebt de kortere tijdschalen nodig (geleverd door een attoseconde laser). Anders, je ziet alleen het begin en het einde, en je weet niet wat er nog meer is gebeurd in de tussentijd."
Het experiment toonde duidelijk aan dat de buitenste elektronen van IBr, eenmaal opgewonden, zie plotseling een verscheidenheid aan staten of plaatsen waar ze zouden kunnen zijn en verken veel van hen voordat ze beslissen welk pad te nemen. In dit eenvoudige molecuul, echter, alle paden leiden ertoe dat het elektron zich op jodium of broom nestelt en de twee atomen uit elkaar vliegen.
Bij grotere moleculen die het team binnenkort hoopt te verkennen, geëxciteerde elektronen zouden meer keuzes hebben, sommige waar de energie in een draai gaat, zoals met rodopsine, of in moleculaire vibratie zonder dat de moleculen uit elkaar vallen.
"In de biologie, het blijkt dat de evolutie dingen heeft geselecteerd die buitengewoon effectief zijn in het absorberen van de energie en het niet verbreken van een band, ' zei Leone. 'Als er iets misgaat in je scheikunde, dan zie je ziektes opduiken.'
 Onderzoeker gebruikt netwerkwetenschap om te begrijpen hoe materialen werken
Onderzoeker gebruikt netwerkwetenschap om te begrijpen hoe materialen werken Had het vroege leven lang nodig, complexe moleculen om celachtige compartimenten te maken?
Had het vroege leven lang nodig, complexe moleculen om celachtige compartimenten te maken? Wat betekent titratie?
Wat betekent titratie?  Onderzoekers geven eerste chemische kaart van kleurstoffen vrij uit historische kleurstofbibliotheek
Onderzoekers geven eerste chemische kaart van kleurstoffen vrij uit historische kleurstofbibliotheek Freeze-frame microscopie legt moleculen vast en laadt op DNA
Freeze-frame microscopie legt moleculen vast en laadt op DNA
 Bundel omhoog:bitter koud weer grijpt noordelijk VS aan
Bundel omhoog:bitter koud weer grijpt noordelijk VS aan NASA ziet tropische cycloon Haleh verzwakken
NASA ziet tropische cycloon Haleh verzwakken Moessonregens overspoelen Filippijnse dorpen, duizenden evacueren
Moessonregens overspoelen Filippijnse dorpen, duizenden evacueren Luchthaven Bali gesloten terwijl Agung-vulkaan kolom van ash . gutst
Luchthaven Bali gesloten terwijl Agung-vulkaan kolom van ash . gutst Onorthodoxe ontziltingsmethode kan het wereldwijde waterbeheer transformeren
Onorthodoxe ontziltingsmethode kan het wereldwijde waterbeheer transformeren
Hoofdlijnen
- Music Science Fair Project Ideas
- De virale parasieten van gigantische virussen in de loop van de tijd volgen
- Relatie tussen DNA-basen Genen, eiwitten en eigenschappen
- Hoe geslachtsaanpassende chirurgie werkt
- Wetenschappers vinden ontbrekende aanwijzing over hoe hiv cellen hackt om zichzelf te verspreiden
- Reflecteert Saturnus licht?
- Wat is de structuur van stamcellen?
- Wat is zelfrespect?
- Wat is de structurele classificatie van het zenuwstelsel?
- Brandstof uit diamanten?

- Samengestelde metalen schuimen nemen de hitte, dichter bij wijdverbreide toepassingen komen

- Hoe materialen te programmeren

- Zeer functioneel membraan ontwikkeld voor de productie van zoetwater uit zeewater
- Versneld klinisch gebruik van Raman-spectroscopie chemische vingerafdrukken

 Ruimtewandelende astronauten geven nieuwe hand aan robotarm
Ruimtewandelende astronauten geven nieuwe hand aan robotarm Techniek stelt onderzoekers in staat om de werking van medicijnen te focussen via infrarood licht
Techniek stelt onderzoekers in staat om de werking van medicijnen te focussen via infrarood licht Wat zijn de voordelen van biologisch afbreekbaar plastic?
Wat zijn de voordelen van biologisch afbreekbaar plastic?  Twitter brengt verkiezingslabels terug voor Amerikaanse kandidaten voor 2020
Twitter brengt verkiezingslabels terug voor Amerikaanse kandidaten voor 2020 Met revolutionaire camera kunnen wetenschappers de evolutie van oude sterren voorspellen
Met revolutionaire camera kunnen wetenschappers de evolutie van oude sterren voorspellen Angst voor Big Brother leidt EU-regels over AI
Angst voor Big Brother leidt EU-regels over AI Awesome Atlas levert next-gen high-speed Echostar 19 internet sat in een baan voor Amerika
Awesome Atlas levert next-gen high-speed Echostar 19 internet sat in een baan voor Amerika Ingenieurs maken drugstesten efficiënter en betaalbaarder
Ingenieurs maken drugstesten efficiënter en betaalbaarder
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

