
Wetenschap
Wat is het moleculaire gedrag?
Moleculair gedrag:een diepe duik
De term "moleculair gedrag" omvat de verschillende manieren waarop moleculen met elkaar en hun omgeving omgaan. Deze ingewikkelde dans van moleculen bepaalt de eigenschappen van materie, van het eenvoudige gedrag van gassen tot de complexe processen in levende organismen. Hier is een uitsplitsing van belangrijke aspecten:
1. Moleculaire beweging:
* Kinetische moleculaire theorie: Deze theorie beschrijft de constante beweging van moleculen. Het type beweging hangt af van de toestand van de materie:
* gassen: Moleculen bewegen vrij en willekeurig in alle richtingen en botsen vaak tegen elkaar en de containerwanden.
* vloeistoffen: Moleculen bewegen langzamer dan gassen en ervaren zowel translationele als rotatiebeweging. Ze kunnen ook trillen en roteren.
* vaste stoffen: Moleculen zijn strak verpakt en trillen in vaste posities.
* Temperatuur: Naarmate de temperatuur toeneemt, bewegen moleculen sneller en hebben meer kinetische energie. Deze verhoogde energie leidt tot veranderingen in de staat (bijv. Smelten, koken) en beïnvloedt reactiesnelheden.
2. Intermoleculaire krachten (IMF's):
* attracties tussen moleculen: Deze krachten komen voort uit tijdelijke of permanente elektrostatische interacties tussen moleculen.
* Soorten IMF's:
* van der Waals krachten: Dit zijn zwakke, tijdelijke krachten veroorzaakt door tijdelijke fluctuaties in elektronenverdeling. Ze omvatten de dispersiekrachten in Londen (aanwezig in alle moleculen) en dipool-dipoolkrachten (aanwezig in polaire moleculen).
* waterstofbinding: Dit is een sterk type dipool-dipoolinteractie waarbij een waterstofatoom is gebonden aan een sterk elektronegatief atoom (zoals zuurstof, stikstof of fluor).
* impact op eigenschappen: IMF's beïnvloeden het smeltpunt van een stof, het kookpunt, de viscositeit en de oplosbaarheid. Sterkere IMF's leiden tot hogere smelt- en kookpunten, grotere viscositeit en lagere oplosbaarheid in niet-polaire oplosmiddelen.
3. Chemische reacties:
* bindingen breken en vormen: Moleculair gedrag staat centraal in chemische reacties. Tijdens reacties worden bestaande bindingen tussen atomen verbroken en worden nieuwe bindingen gevormd, wat resulteert in het creëren van verschillende moleculen.
* factoren die de reactiesnelheden beïnvloeden:
* Temperatuur: Hogere temperaturen verhogen de kinetische energie van moleculen, wat leidt tot frequentere en energetische botsingen, waardoor de reactiesnelheid wordt verhoogd.
* concentratie: Hogere concentraties reactanten betekenen meer botsingen, wat leidt tot een snellere reactie.
* oppervlakte: Verhoogd oppervlak zorgt voor meer contactpunten tussen reactanten, waardoor de reactiesnelheid wordt verhoogd.
* katalysatoren: Deze stoffen versnellen de reacties zonder zichzelf te consumeren door een alternatieve reactieroute te bieden met lagere activeringsenergie.
4. Biologische systemen:
* enzymen: Deze biologische katalysatoren zijn eiwitten met specifieke vormen waarmee ze kunnen binden aan specifieke moleculen en biochemische reacties in levende organismen vergemakkelijken.
* Cellulaire processen: Moleculair gedrag is fundamenteel voor alle cellulaire processen, inclusief energieproductie, transport, signaaltransductie en DNA -replicatie.
* Drugsontwikkeling: Inzicht in moleculair gedrag is cruciaal bij het ontwikkelen van geneesmiddelen die interageren met specifieke doelmoleculen in het lichaam.
Samenvattend omvat moleculair gedrag een complex samenspel van beweging, krachten en interacties. Dit gedrag regelt de fysische en chemische eigenschappen van materie en is cruciaal voor het begrijpen van de ingewikkelde werking van het leven zelf.
 Team ontdekt ongelooflijk diverse microbiële gemeenschap hoog in Yellowstone
Team ontdekt ongelooflijk diverse microbiële gemeenschap hoog in Yellowstone Wat betekent spanning in de wetenschap?
Wat betekent spanning in de wetenschap?  Verschil tussen levende en niet-dingen?
Verschil tussen levende en niet-dingen?  Het energiebeleid van China moet de luchtkwaliteit in evenwicht brengen, doelstellingen voor koolstofemissies en waterschaarste
Het energiebeleid van China moet de luchtkwaliteit in evenwicht brengen, doelstellingen voor koolstofemissies en waterschaarste Beschrijf de materie en leg uit waarom licht niet toe doet?
Beschrijf de materie en leg uit waarom licht niet toe doet?
Hoofdlijnen
- Welke feiten beïnvloeden zaadkieming?
- Genetische variatie in bacteriële populaties kan niet voortvloeien uit?
- Wat is het belang van pH in de landbouw?
- Wat betekent axonaal?
- Welke mutaties komen voor tijdens de celdeling?
- De lymfocyten die bloed- en weefselvloeistoffen bewaken, zijn welk type cel?
- De ontwerpprincipes van celcompartimenten blootleggen
- Kunnen verschillende allelen een enkele eigenschap beïnvloeden?
- Wat zijn enkele van de veldenwetenschap waaraan de evolutionaire biologie bijdraagt?
- Van Zuidoost-Azië tot de riolen:studie bepaalt nieuwe geografische oorsprong van bruine ratten
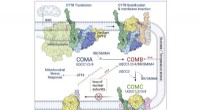
- Kleine eiwitten spelen grote rol in cellulaire energiebalans
- Indonesië's selfiesnagende aap uitgeroepen tot Persoon van het Jaar

- Wat is er nodig om de regent-honingeter te redden?

- Hoe ziekteverwekkers mitochondriale afweermechanismen kunnen uitschakelen
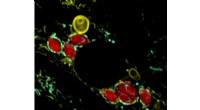
 Welke organel produceert koolhydraten voor de plantencel?
Welke organel produceert koolhydraten voor de plantencel?  Wat is het verste object op aarde dat een persoon zonder hulp kan zien?
Wat is het verste object op aarde dat een persoon zonder hulp kan zien?  Wat zijn twee primaire energiebronnen die levende wezens hebben?
Wat zijn twee primaire energiebronnen die levende wezens hebben?  Ik hou van plastic:de giftige liefdesaffaire van Pakistan met afval
Ik hou van plastic:de giftige liefdesaffaire van Pakistan met afval Wat is de relatie tussen verplaatsing en snelheid?
Wat is de relatie tussen verplaatsing en snelheid?  Welk weefsel van een plant slaat suiker en zetmeel op?
Welk weefsel van een plant slaat suiker en zetmeel op?  DIO-additieven dragen bij aan efficiëntie van polymere zonnecellen
DIO-additieven dragen bij aan efficiëntie van polymere zonnecellen Welke vorm van energie geproduceerd wanneer een gitaarreeks trilt?
Welke vorm van energie geproduceerd wanneer een gitaarreeks trilt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

