Wetenschap
Nano-lokvogel lokt menselijk influenza A-virus naar zijn ondergang
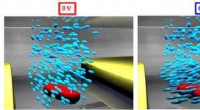
Een zorgvuldig geconstrueerd bolvormig nanodeeltje bedekt met siaalzuur lokt het influenza A-virus naar zijn ondergang. Krediet:Rensselaer Polytechnisch Instituut
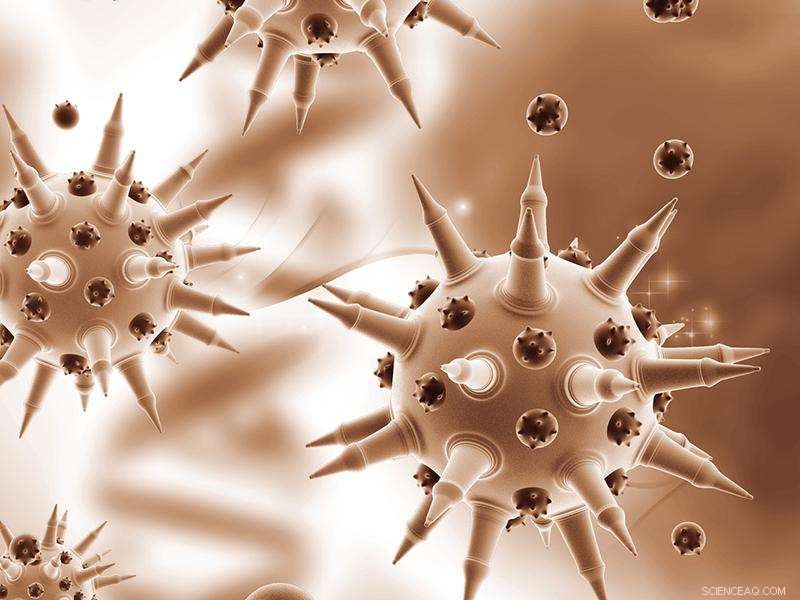
Om zijn slachtoffers te besmetten, influenza A gaat naar de longen, waar het zich vastklampt aan siaalzuur op het oppervlak van cellen. Dus creëerden onderzoekers de perfecte lokvogel:een zorgvuldig geconstrueerd bolvormig nanodeeltje bedekt met siaalzuur lokt het influenza A-virus naar zijn ondergang. Wanneer verneveld in de longen, de nanodeeltjes vallen influenza A, vasthouden totdat het virus zichzelf vernietigt.
In een onderzoek bij muizen met een verzwakt immuunsysteem, de behandeling verminderde de sterfte aan influenza A van 100 procent naar 25 procent gedurende 14 dagen. De nieuwe benadering, die radicaal verschilt van bestaande influenza A-vaccins, en behandelingen op basis van neuraminidaseremmers, zou kunnen worden uitgebreid tot een groot aantal virussen die een vergelijkbare benadering gebruiken om mensen te infecteren, zoals Zika, hiv, en malaria. De resultaten zijn vandaag gepubliceerd in de geavanceerde online editie van het tijdschrift Natuur Nanotechnologie .
"In plaats van het virus te blokkeren, we hebben het doelwit nagebootst - het is een volledig nieuwe benadering, " zei Robert Linhardt, een glycoproteïne-expert en professor aan het Rensselaer Polytechnic Institute die het onderzoek leidde. "Het is effectief bij griep en we hebben reden om aan te nemen dat het met veel andere virussen zal werken. Dit kan een therapie zijn in gevallen waarin vaccineren geen optie is, zoals blootstelling aan een onverwachte soort, of met immuungecompromitteerde patiënten."
Het project is een samenwerking tussen onderzoekers binnen het Centre for Biotechnology and Interdisciplinary Studies (CBIS) van Rensselaer en verschillende instellingen in Zuid-Korea, waaronder de Kyungpook National University. Hoofdauteur Seok-Joon Kwon, een CBIS-onderzoeker, coördineerde het project over de grenzen heen, waardoor de Zuid-Koreaanse instellingen een medicijn kunnen testen dat bij Rensselaer is ontworpen en gekarakteriseerd. Auteurs waren onder meer Kwon, Linhardt, Ravi S. Kane, Jonathan S. Dordick, Marc Douaisi, en Fuming Zhang bij Rensselaer; en de Koreaanse onderzoekers Kyung Bok Lee, Dong Hee Na, Jong Hwan Kwak, Eun Ji-park, Jong-Hwan-park, Hana Youn, en Chang-Seon Song.
Om toegang te krijgen tot het binnenste van een cel en zichzelf te repliceren, influenza A moet eerst aan het celoppervlak binden, en snijdt zichzelf dan los. Het bindt zich met het eiwit hemagglutinine, en verbreekt de verbinding met het enzym neuraminidase. Influenza A produceert talrijke variaties van zowel hemagglutinine als neuraminidase, dit zijn allemaal antigenen binnen de ziekteverwekker die een reactie van het immuunsysteem uitlokken. Influenza A-stammen worden gekenmerkt door de variatie van hemagglutinine en neuraminidase die ze dragen, dus de oorsprong van de bekende H1N1- of H3N2-aanduidingen.
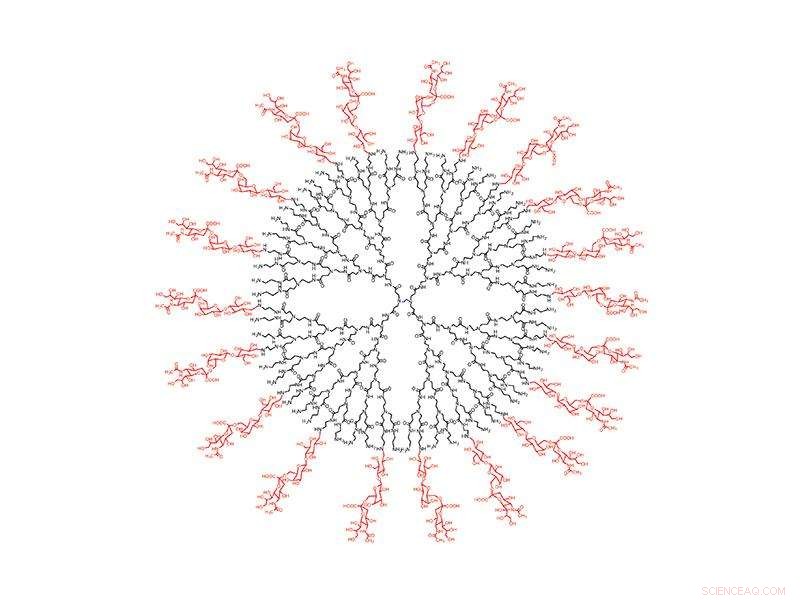
Een zorgvuldig geconstrueerd bolvormig nanodeeltje bedekt met siaalzuur lokt het influenza A-virus naar zijn ondergang. Krediet:Rensselaer Polytechnisch Instituut
Medicijnen om het virus tegen te gaan bestaan, maar ze zijn allemaal kwetsbaar voor de voortdurende antigene evolutie van het virus. Een jaarlijks vaccin is alleen effectief als het overeenkomt met de virusstam die het lichaam infecteert. En het virus heeft het vermogen getoond om resistentie te ontwikkelen tegen een klasse van therapieën gebaseerd op neuraminidaseremmers, die neuraminidase binden en blokkeren.
De nieuwe oplossing richt zich op een aspect van infectie dat niet verandert:alle hemagglutininevarianten van influenza A moeten binden aan menselijk siaalzuur. Om het virus te vangen, het team ontwierp een dendrimeer, een bolvormig nanodeeltje met boomachtige takken die uit de kern komen. Op de buitenste takken, ze bevestigden moleculen, of "liganden, " van siaalzuur.
Uit het onderzoek bleek dat de grootte van het dendrimeer en de afstand tussen de liganden een integraal onderdeel is van de functie van het nanodeeltje. Hemagglutinine komt voor in clusters van drie, of "trimeren, " op het oppervlak van het virus, en onderzoekers ontdekten dat een afstand van 3 nanometer tussen liganden resulteerde in de sterkste binding aan de trimeren. Eenmaal gebonden aan het dicht opeengepakte dendrimeer, virale neuraminidase kan de link niet verbreken. De vacht van het virus bevat miljoenen trimeren, maar uit het onderzoek bleek dat slechts een paar schakels het virus ertoe aanzetten zijn genetische lading te ontladen en uiteindelijk zichzelf te vernietigen.
Een andere benadering, met behulp van een minder gestructureerd nanodeeltje, was eerder getest in niet-gerelateerd onderzoek, maar het geselecteerde nanodeeltje bleek zowel giftig, en kan worden geïnactiveerd door neuraminidase. De nieuwe aanpak is veel veelbelovender.
"De belangrijkste prestatie was het ontwerpen van een architectuur die is geoptimaliseerd om zo stevig aan de hemagglutinine te binden, de neuraminidase kan er niet in knijpen en het virus vrijmaken, "zei Linhardt. "Hij zit vast."
 Welk effect heeft de temperatuur op het diffusieproces?
Welk effect heeft de temperatuur op het diffusieproces?  Polymeer afgeleid van materiaal in de schelpen van garnalen kan geneesmiddelen tegen kanker afleveren op tumorplaatsen
Polymeer afgeleid van materiaal in de schelpen van garnalen kan geneesmiddelen tegen kanker afleveren op tumorplaatsen sneller, groenere manier om koolstofbollen te produceren
sneller, groenere manier om koolstofbollen te produceren Kankercellen kunnen over langere afstanden in het lichaam communiceren
Kankercellen kunnen over langere afstanden in het lichaam communiceren Nieuw katalytisch effect ontdekt voor de productie van galliumoxide
Nieuw katalytisch effect ontdekt voor de productie van galliumoxide
 Westelijkste provincie van Canada roept noodtoestand uit vanwege bosbranden
Westelijkste provincie van Canada roept noodtoestand uit vanwege bosbranden Littekens achtergelaten door ijsbergen record West-Antarctische ijsterugtocht
Littekens achtergelaten door ijsbergen record West-Antarctische ijsterugtocht Afbeelding:Washington D.C. vanuit een baan om de aarde
Afbeelding:Washington D.C. vanuit een baan om de aarde Infrarood NASA-beelden bieden Paulettes temperatuurpalet
Infrarood NASA-beelden bieden Paulettes temperatuurpalet Bestrijding van 18 branden, Californië kan het ergste brandseizoen tegemoet gaan
Bestrijding van 18 branden, Californië kan het ergste brandseizoen tegemoet gaan
Hoofdlijnen
- Celcyclus Feiten
- Studie vindt potentiële celreceptoren om antibioticaresistentie te verminderen
- Verschillen in mannelijke en vrouwelijke chromosomen
- Hoe fotosynthese licht vangt en het leven op aarde aandrijft
- zeehonden, vogels en mensen strijden om vis in de Oostzee
- Groene Brexit laten werken voor landbouw en milieu
- Hoe creëren de hersenen een ononderbroken kijk op de wereld?
- Wat zijn de gespecialiseerde cellen die vasculair weefsel vormen?
- Nieuw fundamenteel inzicht in de strijd tegen bacteriën
 Wat wordt geoxideerd en wat wordt er gereduceerd in celademhaling?
Wat wordt geoxideerd en wat wordt er gereduceerd in celademhaling?  Israëlische archeologen beweren de oude stad te hebben ontdekt
Israëlische archeologen beweren de oude stad te hebben ontdekt Moeilijk uit te rekken silicium wordt superelastisch
Moeilijk uit te rekken silicium wordt superelastisch Trig gebruiken om de hoogte van dingen te berekenen
Trig gebruiken om de hoogte van dingen te berekenen  De CO2-compensatiemarkt:de waarde van boskoolstoffen in het Braziliaanse Amazonegebied benutten
De CO2-compensatiemarkt:de waarde van boskoolstoffen in het Braziliaanse Amazonegebied benutten Detectie van chemicaliën, spanning meten met potlood en papier
Detectie van chemicaliën, spanning meten met potlood en papier Buitenaardse atmosferen op aarde koken
Buitenaardse atmosferen op aarde koken High-flux tafelbladbron voor femtoseconde harde röntgenpulsen
High-flux tafelbladbron voor femtoseconde harde röntgenpulsen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com