
Wetenschap
Kankeropstoppingen:biomechanische factor bij geïdentificeerde maligniteiten
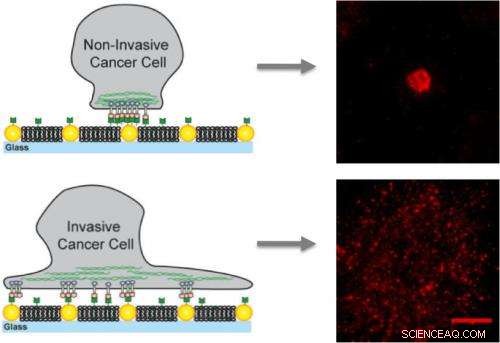
Op kunstmatige membranen ingebed met gouden nanodots, niet-invasieve kankercellen binden alleen aan de nanodots en worden geïmmobiliseerd, terwijl invasieve cellen zich binden aan het membraan en de nanodots en mobiele clusters creëren die bijdragen aan metastase.
(Phys.org) — Er is steeds meer bewijs dat de ontwikkeling en verspreiding van kanker, lang toegeschreven aan genexpressie en chemische signalering die verkeerd is gegaan, omvat ook een biomechanische component. Onderzoekers van het Lawrence Berkeley National Laboratory (Berkeley Lab) hebben dit bewijsmateriaal aangevuld door aan te tonen dat de kwaadaardige activiteit van een kritisch cellulair eiwitsysteem kan voortkomen uit wat in wezen eiwitopstoppingen zijn.
Met behulp van een uniek kunstmatig membraan doordrenkt met een hindernisbaan van gouden nanodots, een onderzoeksteam onder leiding van chemicus Jay Groves bestudeerde het transport van het eiwitsignaleringscomplex EphA2/ephrin-A1 over de oppervlakken van 10 verschillende borstepitheelkankercellijnen die een breed scala aan ziektekenmerken vertonen. De onderzoekers ontdekten dat het transport van dit receptor-ligandcomplex normaal was in gezondere cellijnen, maar vastliep in zieke cellijnen. waarbij de ergste storing plaatsvond in de cellen die het meest ziek waren.
"Er is iets over hoe sterk de EphA2-eiwitten op het celoppervlak zijn geclusterd dat gerelateerd is aan en zelfs kan bijdragen aan het kwaadaardige gedrag van kankercellen, " zegt Groves. "De differentiële blokkering van EphA2-transport tussen de verschillende borstkankercellijnen en de correlatie met ziektekenmerken suggereert dat EphA2-clustering zelf kan bijdragen aan pathologische effecten."
Groves heeft gezamenlijke afspraken met Berkeley Lab's Physical Biosciences Division en UC Berkeley's Chemistry Department, en is ook een onderzoeker van het Howard Hughes Medical Institute (HHMI). Hij is de corresponderende auteur van een paper waarin dit onderzoek in het tijdschrift wordt beschreven Nano-letters getiteld "Nanoscale Obstacle Arrays frustreren het transport van EphA2 / ephrin-A1-clusters in kankercellijnen." Co-auteurs van dit artikel waren Theobald Lohmuller en Qian Xu.
EphA2 behoort tot een familie van enzymen die belangrijke regulatoren zijn van cellulaire processen. Ephrin-A1 is een signaaleiwit dat bindt aan EphA2. Complexen van EphA2/ephrin-A1 zullen zich verzamelen in clusters die vervolgens over het celoppervlak worden getransporteerd. De overexpressie van EphA2 is in verband gebracht met een aantal menselijke kankers, maar komt vooral voor bij borstkanker.
"Ongeveer 40 procent van alle borstkankerpatiënten vertoont een overexpressie van EphA2 die gecorreleerd is met tumormetastase, bijgevolg, veel inspanning is gericht op de ontwikkeling van therapieën die gericht zijn op EphA2, " zegt Groves. "Echter, precies wat er mis gaat met EphA2 dat bijdraagt aan pathologisch celgedrag, blijft onduidelijk, aangezien EphA2 meestal niet gemuteerd is in kankercellen."
Groves is een toonaangevende autoriteit op het opkomende gebied van mechanobiologie, die probeert te begrijpen hoe cellen mechanische krachten voelen en erop reageren. Om te onderzoeken naar een mogelijke mechanische factor in EphA2's verband met borstkanker, Groves gebruikte een techniek die zijn groep ontwikkelde waarbij kunstmatige membranen bestaande uit een vloeibare dubbellaag van lipidemoleculen zijn ingebed met vaste reeksen gouden nanodots. Hierdoor kunnen onderzoekers de afstand of het transport van eiwitten en andere cellulaire moleculen die op de membranen worden geplaatst, controleren.
Voor deze studie is Groves en zijn collega's gebruikten arrays van gouden nanodots om gedefinieerde obstakels te presenteren voor de beweging en assemblage van EphA2/ephrin-A1-clusters. De ephrin-A1-liganden kunnen aan het membraan binden, waardoor de clusters mobiel konden zijn, of naar de nanodots, die de clusters geïmmobiliseerd, of naar beide. De onderzoekers werkten met lijnen van borstkankercellen met vergelijkbare niveaus van EphA2-expressie en omvatten MDA-MB-231, een zeer invasieve en tumorverwekkende lijn, en MCF10A, een relatief goedaardige en niet-tumorigene lijn.
"Als we cellen zien die dezelfde niveaus van EphA2 hebben, maar de MDA-MB-231 is vastgelopen terwijl de MCF10A dat niet is, dan kunnen we zeggen dat het iets is dat verder gaat dan alleen de aantallen EphA2, iets over de manier waarop EphA2 is aangesloten op de rest van de cel dat niet gerelateerd is, " zegt Groves. "Onze waarnemingen suggereren dat het cytoskelet de boosdoener is en dat geneesmiddelen die het cytoskelet moduleren ook de EphA2-clustering therapeutisch kunnen moduleren, waardoor pathologisch gedrag wordt verminderd."
 Maritiem continent verzwakt Aziatische tropische moessonregen door Australische stromen over de evenaar
Maritiem continent verzwakt Aziatische tropische moessonregen door Australische stromen over de evenaar Waarom het verzamelen van water van miljoenen vrouwen tweederangsburgers maakt
Waarom het verzamelen van water van miljoenen vrouwen tweederangsburgers maakt Grote spinnen gevonden in Indiana
Grote spinnen gevonden in Indiana  Onderzoeksteam detecteert een versnelling in het 25-jarige record op zeeniveau via satelliet
Onderzoeksteam detecteert een versnelling in het 25-jarige record op zeeniveau via satelliet Wat zijn de Bobcats Enemies?
Wat zijn de Bobcats Enemies?
Hoofdlijnen
- Een geïntegreerde beoordeling van vaatplantensoorten in Amerika
- Kunnen je hersenen een verkeersopstopping hebben?
- Vermont ziet hedendaags record voor reproductie van Amerikaanse zeearenden
- Microbiële bewoner stelt kevers in staat zich te voeden met een bladdieet
- Hoe fotosynthese licht vangt en het leven op aarde aandrijft
- Planten combineren kleur en geur om bestuivers te verkrijgen
- Hoe komen de spermacellen in een stuifmeelkorrel aan bij de eicelklus in een plant-ovule?
- Waarom zijn mensen hun staart kwijtgeraakt?
- Bevat RNA een genetische code?
- Nieuw materiaal om olievlekken op te vangen?

- Wetenschappers ontwikkelen blaasjes op nanoschaal voor cellulaire leveringen

- 'S Werelds breedste grafeen nanoribbon belooft de volgende generatie geminiaturiseerde elektronica
- Team onthult jungles van koolstofnanobuisjes om moleculen beter te detecteren

- Nanoscopische deeltjes weerstaan volledige inkapseling, simulaties tonen:
 Water halen uit inkt, melk en azijn
Water halen uit inkt, melk en azijn Afbeelding:Antarctische mist
Afbeelding:Antarctische mist China's Huawei gaat 5G-telefoon met opvouwbaar scherm onthullen
China's Huawei gaat 5G-telefoon met opvouwbaar scherm onthullen Door elektronen te bevriezen, komen ze in een rij te staan
Door elektronen te bevriezen, komen ze in een rij te staan Wetenschapsprojecten op magneten voor de vierde rang
Wetenschapsprojecten op magneten voor de vierde rang  Wat is de oorzaak van stofconcentraties boven Oost-Azië?
Wat is de oorzaak van stofconcentraties boven Oost-Azië? Ruimtelijke structuur van gebonden gattoestanden in zwarte fosfor
Ruimtelijke structuur van gebonden gattoestanden in zwarte fosfor Bodemverontreiniging meten
Bodemverontreiniging meten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

