Wetenschap
Hoe het massagetal te vinden
Als u een bepaalde massa van een verbinding heeft, kunt u het aantal moedervlekken berekenen. Omgekeerd, als je weet hoeveel mollen van de verbinding je hebt, kun je de massa berekenen. Voor beide berekeningen moet u twee dingen weten: de chemische formule van de verbinding en de massagetallen van de elementen waaruit deze bestaat. Het massagetal van een element is uniek voor dat element en staat onder het elementsymbool in het periodiek systeem. Het massagetal van een element is niet hetzelfde als zijn atoomnummer.
TL; DR (Te lang; Heeft niet gelezen)
Het atoommassa-nummer van elk element verschijnt onder het symbool in het periodiek systeem. Het staat vermeld in atomaire massa-eenheden, wat gelijk is aan gram /mol.
Atomic-aantal en atoommassagenummer
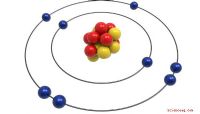
Elk element wordt gekenmerkt door een uniek aantal positief geladen protonen in zijn kern. Waterstof heeft bijvoorbeeld één proton en zuurstof heeft acht. Het periodiek systeem is een rangschikking van de elementen volgens een oplopend atoomnummer. De eerste invoer is waterstof, de achtste is zuurstof enzovoort. De plaats die een element inneemt in het periodiek systeem is een directe indicatie van het atoomnummer, of het aantal protonen in de kern.
Naast de protonen bevatten de kernen van de meeste elementen ook neutronen. Deze fundamentele deeltjes hebben geen lading, maar ze hebben ongeveer dezelfde massa als protonen, dus ze moeten worden opgenomen in de atoommassa. Het atomaire massagetal is de som van alle protonen en neutronen in de kern. Het waterstofatoom kan een neutron bevatten, maar meestal niet, dus het massagetal waterstof is 1. Zuurstof heeft daarentegen een gelijk aantal eiwitten en neutronen, waardoor het massagetal stijgt tot 16. Aftrekken het massagetal van een element uit zijn atoommassa vertelt je het aantal protonen in zijn kern.
Het massagetal vinden
De beste plaats om te zoeken naar het atomaire massagetal van een element is in het periodiek systeem. Het wordt weergegeven onder het symbool voor het element. U wordt misschien verbijsterd door het feit dat dit nummer in veel versies van het periodiek systeem een decimale breuk bevat, die u niet zou verwachten als het werd afgeleid door eenvoudig protonen en neutronen toe te voegen.
De reden hiervoor is dat het getoonde getal het relatieve atoomgewicht is, dat is afgeleid van alle van nature voorkomende isotopen van het element gewogen met het percentage van elk dat optreedt. Isotopen worden gevormd wanneer het aantal neutronen in een element meer of minder is dan het aantal protonen. Sommige van deze isotopen, zoals koolstof-13, zijn stabiel, maar sommige zijn onstabiel en vervallen na verloop van tijd tot een stabielere toestand. Dergelijke isotopen, zoals koolstof-14, zijn radioactief.
Vrijwel alle elementen hebben meer dan één isotoop, dus elk heeft een atoommassa die een decimale breuk bevat. Bijvoorbeeld, de atomaire massa van waterstof opgesomd in het periodiek systeem is 1.008, die voor koolstof is 12.011 en die voor zuurstof is 15.99. Uranium, met een atoomnummer van 92, heeft drie van nature voorkomende isotopen. Zijn atoommassa is 238.029. In de praktijk rondt een wetenschapper het massagetal af op het dichtstbijzijnde gehele getal.
Eenheden voor massaproductie
De eenheden voor atomaire massa zijn in de loop der jaren verfijnd, en vandaag gebruiken wetenschappers de uniforme atomaire massaeenheid ( amu, of gewoon u). Het is gedefinieerd als gelijk aan exact een twaalfde van de massa van een ongebonden koolstof-12-atoom. Per definitie is de massa van één mol van een element, of het getal van Avogadro (6.02 x 10 23) van atomen, gelijk aan de atomaire massa in grammen. Met andere woorden, 1 amu = 1 gram /mol. Dus als de massa van één waterstofatoom 1 amu is, is de massa van één mol waterstof 1 gram. De massa van één mol koolstof is daarom 12 gram en die van uranium is 238 gram.
Hoofdlijnen
- Waarom is chemie belangrijk voor de studie van anatomie en fysiologie?
- Fase waarin de Nucleus & Nucleolus zijn hervormd
- Hebben mensen en bananen echt 50 procent van hetzelfde DNA?
- Iteratieve evolutie:is de Aldabra-rail twee keer geëvolueerd?
- Cilia: definitie, types en functie
- Hoe schimmel te identificeren in petrischalen
- Hoe werken Mexicaanse springbonen?
- Mitosis: definitie, stadia en doel
- "How Do Plant Cells Grow?
 Hoe converteer je van gram naar liter met Density
Hoe converteer je van gram naar liter met Density Hoe het volume van een pijp te berekenen
Hoe het volume van een pijp te berekenen  Glas smelten met een zaklamp
Glas smelten met een zaklamp Berekeningspercentage relatief bereik
Berekeningspercentage relatief bereik  Hoe gemiddelden van percentages berekenen
Hoe gemiddelden van percentages berekenen De effecten van bodemerosie
De effecten van bodemerosie Narwal de "Unicorn" Puppy heeft zijn tweeling geabsorbeerd, waarschijnlijk
Narwal de "Unicorn" Puppy heeft zijn tweeling geabsorbeerd, waarschijnlijk  De magnetische noordpool van de aarde is de afgelopen 40 jaar snel verschoven
De magnetische noordpool van de aarde is de afgelopen 40 jaar snel verschoven
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com