
Wetenschap
Hoe legt de theorie uit waarom vaste stoffen hun vormen behouden?
kmt en vaste stoffen:
* Sterke intermoleculaire krachten: De deeltjes (atomen, ionen of moleculen) in een vaste stof worden bij elkaar gehouden door sterke aantrekkelijke krachten (zoals ionische bindingen, covalente bindingen of metalen bindingen). Deze krachten zijn veel sterker dan in vloeistoffen of gassen.
* Vaste posities: Vanwege de sterke krachten trillen deeltjes in een vaste trillen in vaste posities. Ze hebben niet de vrijheid om te bewegen als deeltjes in vloeistoffen of gassen.
* Pakking sluiten: De deeltjes in een vaste stof zijn nauw aan elkaar verpakt, waardoor weinig lege ruimte tussen hen achterblijft.
Waarom dit een vaste vorm verklaart:
* Stijfheid: De sterke krachten en vaste posities van deeltjes geven vaste stenheid hun stijfheid. Ze weerstaan vervorming en behouden hun vorm.
* Onverwikkbaarheid: Omdat de deeltjes stevig zijn verpakt, zijn vaste stoffen bijna niet -samendrukbaar. Je kunt ze niet gemakkelijk in een kleiner volume persen.
* definitief volume: De vaste posities van deeltjes leiden tot een bepaald volume voor een vaste stof. Het verandert niet veel, zelfs als u druk uitoefent.
Voorbeeld:
Stel je een ijsblok voor. De watermoleculen in het ijs zijn vergrendeld in een kristallijne structuur. Ze trillen op hun plaats, maar ze bewegen niet vrij. Deze structuur geeft het ijs zijn vaste vorm. Als je het ijs probeert te comprimeren, zul je het erg moeilijk vinden om dit te doen, omdat de moleculen al goed zijn verpakt.
Belangrijke opmerking:
Hoewel vaste stoffen over het algemeen star zijn, kunnen ze vervormen onder bepaalde omstandigheden, zoals hoge druk of extreme temperatuur. Dit komt omdat de sterke krachten die de deeltjes bij elkaar houden, kunnen worden overwonnen.
Samenvattend legt de KMT uit dat de sterke intermoleculaire krachten, vaste posities en nauwe verpakking van deeltjes in vaste stoffen verantwoordelijk zijn voor hun rigide, niet -samendrukbare en definitieve vorm.
 Wat is de lading voor neutronen in chloor?
Wat is de lading voor neutronen in chloor?  Wat is de chemische reactie tussen water en calciumsulfaat?
Wat is de chemische reactie tussen water en calciumsulfaat?  Welk element is verantwoordelijk voor de gele kleur van kaliumchromaat?
Welk element is verantwoordelijk voor de gele kleur van kaliumchromaat?  Wat is de hoeveelheid H2O -moleculen in 20G CUSO4.5H2O?
Wat is de hoeveelheid H2O -moleculen in 20G CUSO4.5H2O?  Hoe schrijft u koolstofdisulfide reageert met zuurstofgas om dioxide- en zwavelgas te produceren?
Hoe schrijft u koolstofdisulfide reageert met zuurstofgas om dioxide- en zwavelgas te produceren?
 De intensiteit van bosbranden heeft invloed op de waterkwaliteit en de behandeling ervan in beboste stroomgebieden
De intensiteit van bosbranden heeft invloed op de waterkwaliteit en de behandeling ervan in beboste stroomgebieden Hoe veroorzaakt de omgeving variaties in organismen?
Hoe veroorzaakt de omgeving variaties in organismen?  Wetenschappers stellen een nieuwe benchmarkvaardigheid voor voor decadale voorspelling van terrestrische wateropslag
Wetenschappers stellen een nieuwe benchmarkvaardigheid voor voor decadale voorspelling van terrestrische wateropslag NASA-NOAA-satelliet vangt kortstondige tropische cycloon Bouchra
NASA-NOAA-satelliet vangt kortstondige tropische cycloon Bouchra NASA vindt grote tropische cycloon Marcus sterker
NASA vindt grote tropische cycloon Marcus sterker
Hoofdlijnen
- Waarom zien we geen robotbeschavingen die zich snel uitbreiden over het universum?
- Wat is een groot verschil tussen domein eukarya en domeinen bacteriën archaea?
- Hoe zijn de nucleaire envelope nucleolus en chromosomen die aan elkaar zijn gerelateerd, kort elk van deze structuren kort beschuldigen?
- Is dat een teelbal of een iriserende streep? De mannelijke ware kleuren van een vrouwelijke inktvis
- Wat zijn de 3 aspecten van de wetenschap?
- DNA wordt beschreven als het molecuul van?
- Welk organel omringt het celmembraan en bevat erfelijk materiaal?
- Waarom zebravissen beschadigd hartweefsel kunnen regenereren, terwijl andere vissoorten dat niet kunnen
- Hoe een mug te vangen
- Leidse natuurkundigen brengen klonterige supergeleider in beeld

- Onverwacht gedrag van atoomwolken daagt bestaande theorieën uit

- Inspectie van optische waferdefecten bij het 10 nm-technologieknooppunt en verder
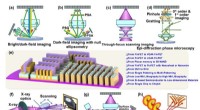
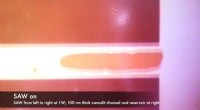
- Onderzoekers gebruiken akoestische golven om vloeistoffen op nanoschaal te verplaatsen
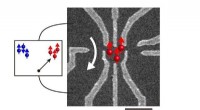
- Toegang krijgen tot hoge spins in een kunstmatig atoom
 Wat gebeurt er als ammoniumdichromaat sterk wordt verwarmd?
Wat gebeurt er als ammoniumdichromaat sterk wordt verwarmd?  Chemici vinden een nieuwe manier om boornitride-nanobuisjes te ontdoen van onzuiverheden
Chemici vinden een nieuwe manier om boornitride-nanobuisjes te ontdoen van onzuiverheden  Actieve machine learning voor de ontdekking en kristallisatie van gigantische polyoxometalaatmoleculen
Actieve machine learning voor de ontdekking en kristallisatie van gigantische polyoxometalaatmoleculen Welke kleur ontstaat door 1 met 9 op het wiel te mengen?
Welke kleur ontstaat door 1 met 9 op het wiel te mengen?  Wat zijn 2 hoofdtypen dieren?
Wat zijn 2 hoofdtypen dieren?  Wetenschappers krijgen inzicht in recyclingprocessen voor nucleair en elektronisch afval
Wetenschappers krijgen inzicht in recyclingprocessen voor nucleair en elektronisch afval Wat zijn rotsen gevormd uit sedimenten die in de loop van de tijd zijn afgezet?
Wat zijn rotsen gevormd uit sedimenten die in de loop van de tijd zijn afgezet?  Hoe de luchtstroom en de statische drukval door de grill te berekenen
Hoe de luchtstroom en de statische drukval door de grill te berekenen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

