
Wetenschap
Nieuwe superresolutiemicroscopiemethode benadert de atomaire schaal
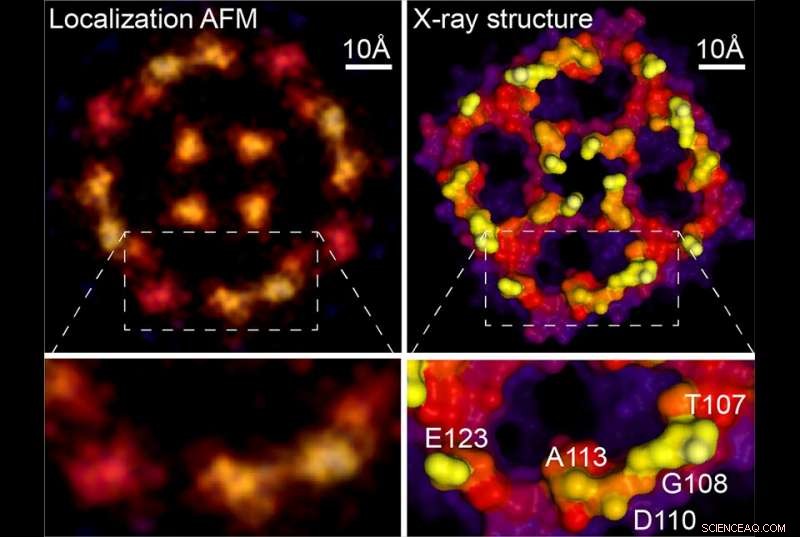
Lokalisatie AFM &X-ray structuur. Krediet:Weill Cornell Medicine, Universiteit van Leeds en Washington University
Wetenschappers van Weill Cornell Medicine hebben een rekentechniek ontwikkeld die de resolutie van atoomkrachtmicroscopie aanzienlijk verhoogt, een gespecialiseerd type microscoop dat de atomen aan een oppervlak "voelt". De methode onthult details op atomair niveau over eiwitten en andere biologische structuren onder normale fysiologische omstandigheden, een nieuw venster openen op celbiologie, virologie en andere microscopische processen.
In een onderzoek, gepubliceerd 16 juni in Natuur , de onderzoekers beschrijven de nieuwe techniek, die is gebaseerd op een strategie die wordt gebruikt om de resolutie in lichtmicroscopie te verbeteren.
Om eiwitten en andere biomoleculen met hoge resolutie te bestuderen, onderzoekers hebben lang vertrouwd op twee technieken:röntgenkristallografie en cryo-elektronenmicroscopie. Hoewel beide methoden moleculaire structuren kunnen bepalen tot aan de resolutie van individuele atomen, ze doen dit op moleculen die ofwel in kristallen zijn gestapeld of bij ultrakoude temperaturen zijn ingevroren, mogelijk veranderen ze van hun normale fysiologische vormen. Atoomkrachtmicroscopie (AFM) kan biologische moleculen analyseren onder normale fysiologische omstandigheden, maar de resulterende afbeeldingen zijn wazig en hebben een lage resolutie.
"Atoomkrachtmicroscopie kan atomen in de natuurkunde gemakkelijk oplossen, op vaste oppervlakken van silicaten en op halfgeleiders, dus het betekent dat de machine in principe de precisie heeft om dat te doen, " zei senior auteur Dr. Simon Scheuring, hoogleraar fysiologie en biofysica in de anesthesiologie bij Weill Cornell Medicine. "De techniek is een beetje alsof je een pen zou nemen en over de Rocky Mountains zou scannen, zodat u een topografische kaart van het object krijgt. In werkelijkheid, onze pen is een naald die tot op enkele atomen scherp is en de objecten zijn enkele eiwitmoleculen."
Echter, biologische moleculen hebben veel kleine onderdelen die wiebelen, hun AFM-beelden vervagen. Om dat probleem aan te pakken, Dr. Scheuring en zijn collega's pasten een concept van lichtmicroscopie aan dat superresolutiemicroscopie wordt genoemd. "Theoretisch was het met optische microscopie niet mogelijk om twee fluorescerende moleculen op te lossen die dichter bij elkaar waren dan de helft van de golflengte van het licht, "zei hij. Echter, door de aangrenzende moleculen te stimuleren om op verschillende tijdstippen te fluoresceren, microscopistes kunnen de verspreiding van elk molecuul analyseren en hun locaties met hoge precisie bepalen.
In plaats van fluorescentie te stimuleren, Het team van Dr. Scheuring merkte op dat de natuurlijke fluctuaties van biologische moleculen die tijdens AFM-scans worden geregistreerd, vergelijkbare spreidingen van positionele gegevens opleveren. Eerste auteur Dr. George Heath, die ten tijde van de studie een postdoctoraal medewerker was bij Weill Cornell Medicine en nu een faculteitslid is aan de Universiteit van Leeds, bezig met cycli van experimenten en computationele simulaties om het AFM-beeldvormingsproces in meer detail te begrijpen en het maximale aan informatie te extraheren uit de atomaire interacties tussen tip en monster.
Met behulp van een methode als superresolutieanalyse, ze waren in staat om afbeeldingen met een veel hogere resolutie van de bewegende moleculen te extraheren. Voortzetting van de topografische analogie, Dr. Scheuring legde uit dat "als de rotsen (d.w.z. atomen) wiebelen een beetje op en neer, je kunt deze detecteren, dan die, en dan bereken je het gemiddelde van alle detecties in de tijd en ontvang je informatie met een hoge resolutie."
Omdat eerdere AFM-onderzoeken routinematig de benodigde gegevens hebben verzameld, de nieuwe techniek kan met terugwerkende kracht worden toegepast op de wazige beelden die het veld decennialang heeft gegenereerd. Als voorbeeld, het nieuwe artikel bevat een analyse van een AFM-scan van een aquaporinemembraaneiwit, oorspronkelijk verworven tijdens het proefschrift van Dr. Scheuring. De heranalyse genereerde een veel scherper beeld dat nauw overeenkomt met de röntgenkristallografiestructuren van het molecuul. "Je krijgt nu in feite een quasi-atomaire resolutie op deze oppervlakken, " zei Dr. Scheuring. Om de kracht van de methode te demonstreren, de auteurs leveren nieuwe gegevens met hoge resolutie over annexine, een eiwit dat betrokken is bij het herstel van celmembranen, en op een protonchloride-antiporter waarvan ze ook structurele veranderingen rapporteren die verband houden met de functionaliteit ervan.
Behalve dat onderzoekers biologische moleculen kunnen bestuderen onder fysiologisch relevante omstandigheden, de nieuwe methode heeft nog andere voordelen. Bijvoorbeeld, Röntgenkristallografie en cryo-elektronenmicroscopie zijn gebaseerd op het middelen van gegevens van grote aantallen moleculen, maar AFM kan afbeeldingen van afzonderlijke moleculen genereren. "In plaats van waarnemingen van honderden moleculen, we observeren honderd keer één molecuul en berekenen een kaart met hoge resolutie, " zei dr. Scheuring.
Het afbeelden van individuele moleculen terwijl ze hun functies uitoefenen, zou geheel nieuwe soorten analyses kunnen openen. "Laten we zeggen dat je een [viraal] spike-eiwit hebt dat zich in één conformatie bevindt en dan wordt het geactiveerd en gaat het in een andere conformatie, " zei Dr. Scheuring. "Je zou in principe een kaart met hoge resolutie kunnen berekenen van datzelfde molecuul terwijl het van de ene conformatie naar de volgende gaat, niet van duizenden moleculen in de ene of de andere conformatie." Dergelijke gegevens met een enkele molecuul met hoge resolutie kunnen meer gedetailleerde informatie opleveren en de mogelijk misleidende resultaten vermijden die kunnen optreden bij het middelen van gegevens van veel moleculen. de kaart zou nieuwe strategieën kunnen onthullen om dergelijke processen nauwkeurig om te leiden of te onderbreken.
 Mix het gewoon door elkaar:nieuwe synthetische methode voor het maken van amfifiele moleculen zonder toevoegingen
Mix het gewoon door elkaar:nieuwe synthetische methode voor het maken van amfifiele moleculen zonder toevoegingen Enzymontdekking kan helpen bij de bestrijding van tuberculose
Enzymontdekking kan helpen bij de bestrijding van tuberculose Veiligheidsmaatregelen bij het gebruik van vlammen in de wetenschap
Veiligheidsmaatregelen bij het gebruik van vlammen in de wetenschap  3D-beeldvormingsonderzoek onthult hoe atomen zijn verpakt in amorfe materialen
3D-beeldvormingsonderzoek onthult hoe atomen zijn verpakt in amorfe materialen Nieuwe methode maakt generieke polymeren lichtgevend
Nieuwe methode maakt generieke polymeren lichtgevend
 Tyfoon Hagibis volgen vanuit de ruimte
Tyfoon Hagibis volgen vanuit de ruimte Californië dringt er bij Trump op aan het plan voor een zwakkere brandstofnorm te laten vallen
Californië dringt er bij Trump op aan het plan voor een zwakkere brandstofnorm te laten vallen Hoe krijg je schonere lucht? Duitsland overweegt gratis openbaar vervoer
Hoe krijg je schonere lucht? Duitsland overweegt gratis openbaar vervoer Geheim van Australische vulkanen onthuld in nieuwe studie
Geheim van Australische vulkanen onthuld in nieuwe studie Wereldwijde luchtvervuilingskaarten nu beschikbaar
Wereldwijde luchtvervuilingskaarten nu beschikbaar
Hoofdlijnen
- Ingenieurs hacken celbiologie om 3D-vormen te maken van levend weefsel
- Is diepgevroren kabeljauw net zo lekker als vers?
- Inzicht in onze levensduur van meer dan 50 jaar die nog steeds in ontwikkeling is, genetische studie toont aan
- Kenmerken van ATP
- Hoe ziet een menselijke cel eruit?
- Nucleus: definitie, structuur en functie (met diagram)
- Processen die ATP als energiebron gebruiken
- Nieuwe soorten mariene spin verschijnen bij eb om wetenschappers aan Bob Marley te herinneren
- Mannelijke dolfijnen bieden geschenken aan om vrouwtjes aan te trekken
- Normale ademhaling stuurt speekseldruppels van 7 voet; maskers verkorten dit
- Theodoliet Soorten

- Maskers blokkeren 99,9% van de grote COVID-gerelateerde druppeltjes:onderzoek

- Deeltjes gevangen in verwrongen materialen en kwantumvingerafdrukken geïdentificeerd

- Volledig optische methode vestigt record voor ultrasnelle beeldvorming met hoge ruimtelijke resolutie
 Thermisch analoog zwart gat is het eens met de stralingstheorie van Hawking
Thermisch analoog zwart gat is het eens met de stralingstheorie van Hawking Hoeveelheid water in stamcellen kan zijn lot bepalen als vet of bot
Hoeveelheid water in stamcellen kan zijn lot bepalen als vet of bot Wetenschappers produceren een magnetisch nanokristal met veel potentiële toepassingen
Wetenschappers produceren een magnetisch nanokristal met veel potentiële toepassingen Magnetisme onder het vergrootglas
Magnetisme onder het vergrootglas Astronomen identificeren enkele van de oudste sterrenstelsels in het heelal
Astronomen identificeren enkele van de oudste sterrenstelsels in het heelal Nieuwe discussies:nanodraden gemaakt van tellurium en nanobuisjes zijn veelbelovend voor draagbare technologie
Nieuwe discussies:nanodraden gemaakt van tellurium en nanobuisjes zijn veelbelovend voor draagbare technologie Wetenschappers vinden optimale leeftijd van stamcellen
Wetenschappers vinden optimale leeftijd van stamcellen Het verschil tussen genomisch DNA en plasmide-DNA
Het verschil tussen genomisch DNA en plasmide-DNA
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Swedish | German | Dutch | Danish | Norway | Spanish | Portuguese |

-
Wetenschap © https://nl.scienceaq.com

