
Wetenschap
Wat versnelt chemische reacties?
1. Temperatuur:
* Hogere temperatuur betekent meer kinetische energie. Moleculen bewegen sneller en botsen vaker, waardoor de kans op succesvolle botsingen die tot reacties leiden vergroten.
2. Concentratie:
* hogere concentratie betekent meer reactant moleculen bij elkaar verpakt. Dit verhoogt de kansen op botsingen en dus de reactiesnelheid.
3. Oppervlakte:
* Een groter oppervlak zorgt voor meer contactpunten tussen reactanten. Denk aan een vaste reactant - het breken in kleinere stukken verhoogt het oppervlak dat wordt blootgesteld aan de andere reactanten, waardoor de reactie wordt versneld.
4. Katalysatoren:
* katalysatoren zijn stoffen die reacties versnellen zonder zelf te worden geconsumeerd. Ze bieden een alternatieve reactieroute met een lagere activeringsenergie, waardoor de reactie sneller kan doorgaan.
5. Druk (voor gasvormige reacties):
* Hogere druk in een gasvormige reactie dwingt moleculen dichter bij elkaar. Dit verhoogt de kansen op botsingen en versnelt dus de reactie.
6. Roeren of agitatie:
* Roeren of agiterende reactanten helpen ze grondig te mengen en vergroot de kans op botsingen. Dit is vooral belangrijk in heterogene reacties (reacties met stoffen in verschillende fasen).
7. Licht (voor fotochemische reacties):
* Licht kan de energie bieden die nodig is om bindingen te verbreken en enkele reacties te initiëren. Dit geldt vooral voor fotochemische reacties.
Het is belangrijk op te merken dat deze factoren kunnen samenwerken om de reactiesnelheden te beïnvloeden. Het verhogen van de temperatuur en concentratie van reactanten zal bijvoorbeeld een veel grotere impact hebben op de reactiesnelheid dan alleen het verhogen van één factor alleen.
 Wanneer calciummetaal reageert met zuurstofgas in de lucht om oxide te vormen Stel dat u reageert 6,55 mol 4,00 nu het aantal geproduceerde mol bepalen?
Wanneer calciummetaal reageert met zuurstofgas in de lucht om oxide te vormen Stel dat u reageert 6,55 mol 4,00 nu het aantal geproduceerde mol bepalen?  Onderzoekers die de grootste uitdaging van waterstof beter begrijpen:verbrossing
Onderzoekers die de grootste uitdaging van waterstof beter begrijpen:verbrossing  Wat is de samengestelde naam voor BL3?
Wat is de samengestelde naam voor BL3?  Lijst met huishoudelijke basen en zuren
Lijst met huishoudelijke basen en zuren  Enorm potentieel voor elektronisch textiel gemaakt met nieuwe cellulosedraad
Enorm potentieel voor elektronisch textiel gemaakt met nieuwe cellulosedraad
 Robots om het Great Barrier Reef te redden
Robots om het Great Barrier Reef te redden Wat is de tak van de aardewetenschap?
Wat is de tak van de aardewetenschap?  Welke bodemomstandigheden is het beste voor het planten van bomen en planten?
Welke bodemomstandigheden is het beste voor het planten van bomen en planten?  Waarom zou winderosie dominanter van vorm en landschapsarchitectuur kunnen zijn om het klimaat te drogen?
Waarom zou winderosie dominanter van vorm en landschapsarchitectuur kunnen zijn om het klimaat te drogen?  Het rook naar zwavel:as valt in de buurt van vulkaan Hawaï
Het rook naar zwavel:as valt in de buurt van vulkaan Hawaï
Hoofdlijnen
- Wat is een ribosoom en wat doet het?
- Waarom lopen mensen rechtop? Het geheim zit in ons bekken
- Wie heeft RNA ontdekt?
- Cellen leven maar niet alle levende cellenorganismen?
- Blokkade in de verwijdering van cellulair afval:Wetenschappers laten zien hoe eiwitaggregaten de moleculaire balans van cellen verstoren
- Welk type gratis RNA -paren met blootgestelde bases?
- Wat is de betekenis van organisme?
- Welke organellen zijn aanwezig in het cytoplasma?
- Wat zijn de verschillen tussen heterozygote en homozyguizend hoe recessieve allels te domineren, spelen er een rol in?
- Polymeerkathode met hoge energiedichtheid voor snelladende natrium- en multivalent-ionbatterijen
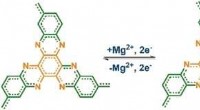
- Methode voor het volgen van reacties tussen lucht en op koolstof gebaseerde verbindingen vastgesteld

- Ultradunne zelfherstellende polymeren creëren nieuwe, duurzame waterafstotende coatings
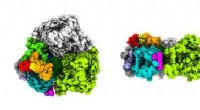
- Unieke pigmenten in fotosynthetische mariene bacterie onthullen hoe het leeft bij weinig licht
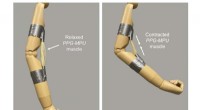
- Hoogenergetisch vormgeheugenpolymeer kan op een dag robots helpen hun spieren te buigen
 Wat is de naam van de naaldboom met naalden die in de herfst geel worden?
Wat is de naam van de naaldboom met naalden die in de herfst geel worden?  Waar ligt het Cherokee National Forest?
Waar ligt het Cherokee National Forest?  Een halve graad minder opwarming kan extreme neerslag voorkomen
Een halve graad minder opwarming kan extreme neerslag voorkomen Is de O op een watercheminformule nul of letter o?
Is de O op een watercheminformule nul of letter o?  Wat is de formule voor tetra koolstofdichloride?
Wat is de formule voor tetra koolstofdichloride?  Wat zijn de namen van andere zonnestelsels in onze melkweg?
Wat zijn de namen van andere zonnestelsels in onze melkweg?  Organismen die door mensen van het ene deel van de wereld naar het andere zijn gebracht, zijn voorbeelden van?
Organismen die door mensen van het ene deel van de wereld naar het andere zijn gebracht, zijn voorbeelden van?  Video:Hoe lood (misschien) de ondergang van het oude Rome veroorzaakte
Video:Hoe lood (misschien) de ondergang van het oude Rome veroorzaakte
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

