
Wetenschap
Waarom zijn de dichtheden van de meeste stoffen met temperatuur opgetrokken?
1. Thermische expansie:
* Moleculaire beweging: Naarmate de temperatuur toeneemt, krijgen moleculen kinetische energie en bewegen ze sneller, waardoor ze krachtiger trillen en oscilleren.
* Verhoogde afstand: Deze verhoogde moleculaire beweging leidt tot een grotere scheiding tussen moleculen, wat resulteert in een uitbreiding van de stof.
* Lagere dichtheid: Met dezelfde massa verdeeld over een groter volume, neemt de dichtheid af.
2. Faseveranderingen:
* smelten en koken: Wanneer een stof overgaat van vaste stof naar vloeistof (smelten) of vloeistof naar gas (koken), neemt de dichtheid aanzienlijk af. Dit komt omdat de moleculen mobieler worden en een groter volume bezetten.
Uitzonderingen:
Hoewel de algemene trend de dichtheid is om af te nemen met de temperatuur, zijn er uitzonderingen, met name voor:
* Water: Water is een abnormale stof. De dichtheid neemt toe van 0 ° C tot 4 ° C en neemt vervolgens af naarmate de temperatuur verder stijgt. Dit komt door de unieke structuur van watermoleculen en hun waterstofbinding.
* Sommige gassen: Bepaalde gassen, zoals lucht, vertonen een lichte toename van de dichtheid met temperatuur als gevolg van de toename van de druk geassocieerd met verwarming.
Samenvattend:
* Thermische uitbreiding: Verhoogde moleculaire beweging leidt tot grotere afstand en lagere dichtheid.
* Faseveranderingen: Smelten en koken resulteren in een significante afname van de dichtheid als gevolg van verhoogde moleculaire mobiliteit.
Het is echter belangrijk op te merken dat er uitzonderingen zijn, zoals water, waarbij het dichtheidsgedrag complexer is.
 De grenzen van Australië zijn open, dus waar zijn al die backpackers?
De grenzen van Australië zijn open, dus waar zijn al die backpackers?  Onderzoekers bestuderen hoe klimaatverandering de gewassen in India beïnvloedt
Onderzoekers bestuderen hoe klimaatverandering de gewassen in India beïnvloedt  Drones tellen de kosten van de 2017 B.C. bosbranden
Drones tellen de kosten van de 2017 B.C. bosbranden Heeft wonen in de buurt van windturbines een negatieve invloed op de menselijke gezondheid?
Heeft wonen in de buurt van windturbines een negatieve invloed op de menselijke gezondheid? Dangerous Desert Plants
Dangerous Desert Plants
Hoofdlijnen
- Auto-immuniteit kan verklaren waarom een belangrijk immuunsysteem bij veel bacteriën ontbreekt
- Wat zijn de verschillen tussen een CZS en een PNS?
- Het vermogen van cellen om hun kenmerken door te geven, is het meest direct gerelateerd aan de van?
- Een van de belangrijkste functie Cellebrum is wat?
- Welk deel van de cel vangt energie van zonlicht en gebruikt deze om voedsel voor cel te produceren?
- De reis van mangroven in Zuid-Japan volgen
- Drie manieren waarop RNA en DNA verschillen?
- Wat is de naam van wetenschapper die evolutie bestudeerde?
- Wat is de wetenschappelijke definitie van meniscus?
- Wetenschappers ontdekken autofagieremmende peptiden van gigantische ankyrinen
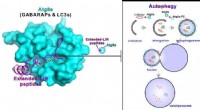
- Onderzoekers volgen eiwitbinding, bouwen synthetische eiwitten om genexpressie te bestuderen

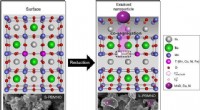
- Ontwikkeling van betere fabricagetechnieken voor pH-responsieve microcapsules

- Nieuwe koolwaterstofbrandstofcellen met hoog rendement en lage kosten
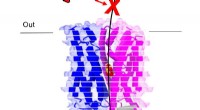
- Wetenschappers ontdekken hoe malariaparasieten suiker importeren
 Een voorbeeld van een oplossing met 1 oplosmiddel en 2 opgeloste stoffen?
Een voorbeeld van een oplossing met 1 oplosmiddel en 2 opgeloste stoffen?  Zal de brandstof zwaarder of lichter worden als hij brandt?
Zal de brandstof zwaarder of lichter worden als hij brandt?  Hoe vormen de meeste grotten zich?
Hoe vormen de meeste grotten zich?  Wat zijn de drie concepten waaruit de celtheorie bestaat?
Wat zijn de drie concepten waaruit de celtheorie bestaat?  Wat gebeurt er als chloorgas wordt toegevoegd aan kaliumjodide -oplossing?
Wat gebeurt er als chloorgas wordt toegevoegd aan kaliumjodide -oplossing?  Wat maakt stollingsrotsen verschillende kristalgroottes?
Wat maakt stollingsrotsen verschillende kristalgroottes?  Brazilië schrapt bod om Amazone-natuurreservaat te ontginnen
Brazilië schrapt bod om Amazone-natuurreservaat te ontginnen Wat is de formule voor lithiumwaterstoffosfaat?
Wat is de formule voor lithiumwaterstoffosfaat?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

