
Wetenschap
Hoe verschillen ijswatermoleculen van warme moleculen?
Moleculen van ijswater:
* lage energie: Moleculen in ijs hebben minder kinetische energie, wat betekent dat ze minder trillen en langzamer bewegen.
* Besteld arrangement: Door de lage energie kunnen de moleculen een sterk gestructureerd, kristallijn rooster vormen. Deze structuur creëert een vaste opstelling met veel lege ruimte tussen de moleculen, waardoor ijs zijn vaste toestand krijgt.
Warm watermoleculen:
* Hoge energie: Warme watermoleculen hebben hogere kinetische energie, wat betekent dat ze meer trillen en sneller bewegen.
* willekeurige opstelling: De hogere energie verstoort het kristallijne rooster, waardoor de moleculen vrij kunnen bewegen en langs elkaar kunnen stromen. Dit resulteert in een meer willekeurige opstelling, waardoor water zijn vloeibare toestand krijgt.
Hier is een eenvoudige analogie:
Stel je een drukke dansvloer voor.
* ijs: Iedereen staat stil en houdt hand in een strikte formatie, met veel ruimte tussen hen.
* warm water: De muziek is luid, mensen dansen en botsen tegen elkaar, bewegen vrij en er is geen vaste formatie.
Belangrijke opmerking:
Terwijl de opstelling en beweging van watermoleculen verschillen in ijs en warm water, blijven de werkelijke moleculen zelf hetzelfde. Het is de energie Dat drijft de verandering in hun gedrag.
Hoofdlijnen
- Wat is de naam van het proces dat zich voordoet in een mitochondria?
- De manier waarop immigranten op tv worden afgebeeld, heeft gevolgen voor het echte leven
- Opinie:Waarom bioplastics onze plasticproblemen niet zullen oplossen
- Big data omzetten in betere rassen en variëteiten:kan AI de planeet helpen voeden?
- Bevat multicellulair organisme triljoenen cellen?
- Wat is de wetenschappelijke naam voor weefsel?
- Laat me je bladeren zien - Gezondheidscontrole voor stadsbomen
- Ontbrekende visvangstgegevens? Niet noodzakelijkerwijs een probleem, zegt een nieuwe studie
- Wat zijn de acht klassen van gewervelde dieren?
- Een nieuwe betaalbare en gebruiksvriendelijke technologie voor de diagnose van droge ogen

- Met trucs voor materiaalverwerking kunnen ingenieurs nieuw lasermateriaal maken

- Nieuwe computerondersteunde chemische synthesemethode vermindert onderzoekstijd en kosten
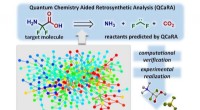
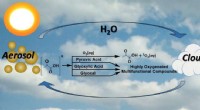
- Organische 2-oxocarbonzuren zorgen voor een link naar de vorming van radicalen en reactieve zuurstofsoorten in atmosferische deeltjes
- Draadloos oplaadbare solid-state supercondensatoren printen voor zachte, slimme contactlenzen

 Morsen in een nucleaire faciliteit toont potentiële brandwondenrisico's van een huishoudelijke chemische stof
Morsen in een nucleaire faciliteit toont potentiële brandwondenrisico's van een huishoudelijke chemische stof Wat beschrijft het beste de beweging van moleculen?
Wat beschrijft het beste de beweging van moleculen?  Terug naar kantoor? Niet alle onderbrekingen op de werkplek zijn slecht voor het bedrijf
Terug naar kantoor? Niet alle onderbrekingen op de werkplek zijn slecht voor het bedrijf  Studie demonstreert een elektronische schakelaar op basis van stereo-isomerie
Studie demonstreert een elektronische schakelaar op basis van stereo-isomerie Hoeveel graden is 150 F in C?
Hoeveel graden is 150 F in C?  Tumorsuppressorgenen: wat is het?
Tumorsuppressorgenen: wat is het?  Wie is de uitvinder van natuurkunde?
Wie is de uitvinder van natuurkunde?  Internationaal team ontwikkelt nieuwe DNA-nanomotor
Internationaal team ontwikkelt nieuwe DNA-nanomotor
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


