
Wetenschap
Waarom smelt een metaal wanneer verwarmd?
De basis
* Atomische structuur: Metalen zijn gemaakt van atomen gerangschikt in een strak gepakte, geordende structuur die een kristalrooster wordt genoemd. Deze atomen worden bij elkaar gehouden door metalen bindingen, een speciaal soort binding waarbij elektronen vrij zijn om door het rooster te bewegen.
* Thermische energie: Warmte is een vorm van energie. Wanneer je een metaal verwarmt, voeg je thermische energie toe aan zijn atomen.
Wat gebeurt er tijdens het smelten
1. Verhoogde trillingen: Terwijl het metaal warmte absorbeert, beginnen de atomen krachtiger te trillen.
2. Verzwakking van bindingen: Deze verhoogde trilling verzwakt de metalen bindingen die de atomen bij elkaar houden in het kristalrooster.
3. BESPRAKING VAN STRUCTUUR: Uiteindelijk worden de trillingen zo sterk dat de atomen de verzwakte bindingen overwinnen, en de geordende, kristallijne structuur breekt af.
4. Overgang naar vloeistof: De metaal gaat over in een vloeibare toestand. In een vloeistof zijn de atomen nog steeds dicht bij elkaar, maar ze kunnen meer vrij bewegen, wat leidt tot een verlies van de rigide, geordende structuur.
Key Points
* smeltpunt: Elk metaal heeft een specifiek smeltpunt, de temperatuur waarbij het overgaat van vaste naar vloeistof. Dit punt hangt af van de sterkte van de metalen bindingen in dat specifieke metaal.
* Energie -input: Smelten vereist een aanzienlijke hoeveelheid energie -input om de krachten te overwinnen die de vaste structuur bij elkaar houden.
* Niet alleen warmte: Hoewel warmte de meest voorkomende manier is om metalen te smelten, kunnen andere factoren het smeltpunt beïnvloeden, zoals druk.
Samenvattend
Het verwarmen van een metaal verhoogt de energie van zijn atomen, waardoor ze intenser trillen. Deze trilling verzwakt de bindingen die het kristalrooster tegen elkaar houden, wat leidt tot een afbraak van de vaste structuur en een overgang naar de vloeibare toestand.
 Welke chemische eigenschappen hebben de producten van elektrolyse die worden geproduceerd door ontledingswater?
Welke chemische eigenschappen hebben de producten van elektrolyse die worden geproduceerd door ontledingswater?  Hoe schrijf je stap voor stap de verbrandingsvergelijking voor benzeen?
Hoe schrijf je stap voor stap de verbrandingsvergelijking voor benzeen?  Welke vormen wanneer Neptunium -atomen uit elkaar vallen?
Welke vormen wanneer Neptunium -atomen uit elkaar vallen?  Wat is de chemische formule van siliconensulfaat?
Wat is de chemische formule van siliconensulfaat?  Welk gas reageert helemaal niet in gloeilampen?
Welk gas reageert helemaal niet in gloeilampen?
 Mobiliteitsbeperkingen kunnen onverwachte gevolgen hebben voor de luchtkwaliteit
Mobiliteitsbeperkingen kunnen onverwachte gevolgen hebben voor de luchtkwaliteit Welke invloed zal de klimaatverandering op uw levensonderhoud hebben?
Welke invloed zal de klimaatverandering op uw levensonderhoud hebben?  Er is een gigantische dode zone in de Golf van Mexico, grotendeels te danken aan vervuiling vanuit Chicago
Er is een gigantische dode zone in de Golf van Mexico, grotendeels te danken aan vervuiling vanuit Chicago Wat zijn drie manieren waarop fysieke wetenschap belangrijk is, je dagelijkse leven?
Wat zijn drie manieren waarop fysieke wetenschap belangrijk is, je dagelijkse leven?  Oorsprong van fotosynthese in planten gedateerd op 1,25 miljard jaar geleden
Oorsprong van fotosynthese in planten gedateerd op 1,25 miljard jaar geleden
Hoofdlijnen
- Welke cel heeft een specifieke taak in een cel?
- Wat doet een kern in eukaryotische cel?
- Waarom zijn er zoveel hondenrassen en maar een paar kattenrassen?
- Welke rollen spelen modellenwetten en theorieën in de wetenschap?
- Hoe kan DNA -hybridisatie een maat voor genetische verwantschap tussen soorten geven?
- Wat betekent het als je witte bloedcellen hebt?
- Evolueren organismen langzaam in de loop van de tijd en kunnen twee verschillende een gemeenschappelijke voorouder hebben?
- Vergelijking voor glucosemetabolisme
- Aard-lucht warmtewisselaar beste manier om landbouwhuisdieren in stallen te beschermen tegen de gevolgen van klimaatverandering
- Nieuwe reactie maakt indoline-steigers beschikbaar voor farmaceutische ontwikkeling

- Ingenieurs vinden een nette manier om afvalkooldioxide om te zetten in bruikbaar materiaal
- Chemici brengen een kunstmatige moleculaire zelfassemblage in kaart met de complexiteit van het leven
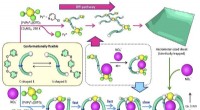
- Onderzoekers verbeteren methode voor het onderzoeken van halfgeleidende kristallen met licht om defecten en onzuiverheden te detecteren
- Eiwitketens die zichzelf tot spiraalvormige vlechten vormen

 Onderzoekers testen op koolstofnanobuisjes gebaseerde geïntegreerde schakelingen met ultralaag voltage
Onderzoekers testen op koolstofnanobuisjes gebaseerde geïntegreerde schakelingen met ultralaag voltage Wat zijn 2 continenten die in juli volledig naar de zon zijn gekanteld?
Wat zijn 2 continenten die in juli volledig naar de zon zijn gekanteld?  Wat is het belangrijkste verschil tussen astronomie en andere takken van de aardewetenschap?
Wat is het belangrijkste verschil tussen astronomie en andere takken van de aardewetenschap?  Welke schadelijke effecten hebben sommige bacteriën op mensen?
Welke schadelijke effecten hebben sommige bacteriën op mensen?  Het veronderstelde gemiddelde bepalen
Het veronderstelde gemiddelde bepalen Beschrijf twee manieren waarop mineralen worden gedolven?
Beschrijf twee manieren waarop mineralen worden gedolven?  Hoeveel elektronen in koolstof?
Hoeveel elektronen in koolstof?  Wat voor soort wetenschapper bestudeert kernenergie?
Wat voor soort wetenschapper bestudeert kernenergie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

