
Wetenschap
Waarom hebben vloeibare stoffen de mogelijkheid om stroomstroom door hen toe te staan?
Dit is waarom:
* elektrolyten bevatten gratis ionen: Elektrolyten zijn oplossingen die ionen bevatten (geladen deeltjes). Deze ionen kunnen vrij bewegen in de vloeistof. Deze bewegingsvrijheid is de sleutel tot geleidbaarheid.
* geleidbaarheid door ionenbeweging: Wanneer een elektrische potentiaal over een elektrolyt wordt toegepast, bewegen de positieve ionen naar de negatieve elektrode en bewegen de negatieve ionen naar de positieve elektrode. Deze beweging van ionen vormt een elektrische stroom.
Voorbeelden van elektrolyten:
* zout water: Opgeloste zout (NaCl) dissocieert in Na+ en clionen, waardoor de stroom mogelijk is.
* zure oplossingen: Zuren zoals zoutzuur (HCL) dissociëren in H+ en clies.
* Basisoplossingen: Bases zoals natriumhydroxide (NaOH) dissociëren in Na+ en OH-ionen.
Waarom andere vloeistoffen niet leiden:
* Puur water: Hoewel watermoleculen polair zijn, heeft zuiver water een zeer lage concentratie ionen. Daarom is het een slechte dirigent.
* Niet-polaire vloeistoffen: Vloeistoffen zoals olie, benzine en alcohol dissociëren niet in ionen. Ze missen de geladen deeltjes die nodig zijn voor de stroomstroom.
Samenvattend:
Vloeistoffen met vrij bewegende ionen kunnen elektriciteit leiden. Deze geleidbaarheid komt voort uit de beweging van deze ionen als reactie op een elektrisch veld. Vloeistoffen die deze mobiele ionen missen, zoals zuiver water of niet-polaire vloeistoffen, zijn slechte elektriciteitsgeleiders.
 Is er iets uit de natuur dat mensen gebruikten?
Is er iets uit de natuur dat mensen gebruikten?  2023–24 El Niño zal in sommige gebieden waarschijnlijk recordbrekende gemiddelde temperaturen veroorzaken
2023–24 El Niño zal in sommige gebieden waarschijnlijk recordbrekende gemiddelde temperaturen veroorzaken  Waarom mensen migreren | Hoe dingen werken
Waarom mensen migreren | Hoe dingen werken  Huidige status van e-waste management in Vietnam
Huidige status van e-waste management in Vietnam Nieuwe theorie legt uit hoe de binnenkern van de aarde solide blijft ondanks extreme hitte
Nieuwe theorie legt uit hoe de binnenkern van de aarde solide blijft ondanks extreme hitte
Hoofdlijnen
- Verbergt de Amerikaanse regering nieuw bewijs van buitenaards leven?
- Dodelijke vispathogeen gedetecteerd in Australië
- In welk seizoen vindt de kieming van planten plaats?
- Wetenschappers bepalen hoe regenboogforel op de juiste manier kan worden gevoerd
- De tertiaire structuur van een eiwit is de?
- Is ooggrootte gerelateerd aan genetica of omgeving?
- Kenmerken uit meerdere bronnen van de strategie voor het gebruik van gewaswater in extreem droge gebieden
- Onderzoek laat zien hoe beschadigde celkernen zichzelf opnieuw afsluiten en repareren
- Wat bevat de informatie in DNA?
- Nieuw polymeer kan de prestaties van organische en perovskiet-zonnecellen verbeteren

- Ingenieurs ontwikkelen recept om kogelvrije vesten drastisch te versterken

- Wetenschappers ontwikkelen proces om brandstof van hogere kwaliteit te produceren uit bioafval

- Bionische idee stimuleert lithium-ion-extractie
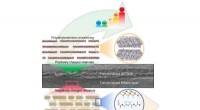
- Tweefasig materiaal met verrassende eigenschappen

 Lunar IceCube doorstaat kritische tests in het Goddard Space Flight Center van NASA
Lunar IceCube doorstaat kritische tests in het Goddard Space Flight Center van NASA Wat zijn de belangrijkste absorberende gassen van energie in de atmosfeer?
Wat zijn de belangrijkste absorberende gassen van energie in de atmosfeer?  Hoe zetten bacteriën stikstofgas in de lucht om in ammoniak?
Hoe zetten bacteriën stikstofgas in de lucht om in ammoniak?  Is magnesium het slaapdrankje dat zandhoppers in staat stelt koude winters te overleven?
Is magnesium het slaapdrankje dat zandhoppers in staat stelt koude winters te overleven?  Welke laag van de aarde bevat dichte materialen zoals ijzer en nikkel?
Welke laag van de aarde bevat dichte materialen zoals ijzer en nikkel?  Wanneer is de eenvoudige lichtmicroscoop uitgevonden?
Wanneer is de eenvoudige lichtmicroscoop uitgevonden?  Kwantumcryptografie:hacken zinloos
Kwantumcryptografie:hacken zinloos Wat gebruik je bij het meten van elektroforese?
Wat gebruik je bij het meten van elektroforese?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

