
Wetenschap
Waarom afneemt dat volume gas afneemt bij toenemende druk IT bij constante temperatuur?
De relatie:Boyle's Law
Deze relatie wordt verklaard door de wet van Boyle , een van de fundamentele gaswetten. Het stelt dat:
* Bij constante temperatuur is het volume van een gas omgekeerd evenredig met zijn druk.
Hier is de intuïtie:
1. Gasmoleculen bewegen constant: Stel je gasmoleculen voor als kleine, stuiterende ballen in een container. Ze bewegen constant rond, botsen met de wanden van de container en met elkaar.
2. Druk is kracht per oppervlakte: Druk is een maat voor hoeveel kracht de gasmoleculen uitoefenen op de containerwanden.
3. Afnemende volume betekent meer botsingen: Als u het volume van de container vermindert, propt u hetzelfde aantal gasmoleculen in een kleinere ruimte. Dit betekent:
* De gasmoleculen hebben minder ruimte om te bewegen.
* Ze raken vaker op de containerwanden.
* Ze oefenen een grotere kracht per eenheidsgebied uit (d.w.z. hogere druk).
Voorbeeld:
Stel je een ballon voor. Als je de ballon perspunt (vermindert het volume), wordt de lucht erin meer gecomprimeerd. Dit betekent dat de luchtmoleculen vaker de rubberen wanden van de ballon raken, waardoor meer druk ontstaat en de ballon moeilijker voelt.
belangrijke opmerkingen:
* constante temperatuur: De wet van Boyle is alleen van toepassing als de temperatuur constant blijft. Als de temperatuur verandert, wordt de relatie tussen volume en druk complexer.
* Ideale gaswet: De wet van Boyle is een speciaal geval van de meer algemene ideale gaswet , die druk, volume, temperatuur en de aanwezige hoeveelheid gas relateert.
Laat het me weten als je andere gaswetten of een ander aspect van gasgedrag wilt verkennen!
 Gestructureerde materialen op meerdere schalen voor elektrokatalyse en foto-elektrokatalyse
Gestructureerde materialen op meerdere schalen voor elektrokatalyse en foto-elektrokatalyse Kan de temperatuur waarbij een stof smelt hetzelfde zijn als de temperatuur verandert van vloeibaar naar vast?
Kan de temperatuur waarbij een stof smelt hetzelfde zijn als de temperatuur verandert van vloeibaar naar vast?  De puzzel voor het ontwerpen van medicijnen voltooien
De puzzel voor het ontwerpen van medicijnen voltooien Is kokend water een voorbeeld van chemische verandering?
Is kokend water een voorbeeld van chemische verandering?  Wat is het verschil tussen ionen en vrije radicalen?
Wat is het verschil tussen ionen en vrije radicalen?
 Waar kunnen overstroomde velden helpen om het grondwater aan te vullen?
Waar kunnen overstroomde velden helpen om het grondwater aan te vullen? Nieuwe studie helpt bij het vinden van de beste locaties voor thermische centrales in IJsland
Nieuwe studie helpt bij het vinden van de beste locaties voor thermische centrales in IJsland Romeinse ruïnes ontdekt onder water in Tunesië
Romeinse ruïnes ontdekt onder water in Tunesië  Steden als Parijs kunnen een optimale stedelijke vorm zijn om de uitstoot van broeikasgassen te verminderen
Steden als Parijs kunnen een optimale stedelijke vorm zijn om de uitstoot van broeikasgassen te verminderen Wat vervangt klimaatopwarmende HFK's in koelkasten en airconditioners?
Wat vervangt klimaatopwarmende HFK's in koelkasten en airconditioners?
Hoofdlijnen
- Onderzoekers ontdekken toxine dat bacteriën op ongekende manieren doodt
- Onderzoekers identificeren combinatie van factoren voor biologische cacaoopbrengst
- Hoe registreren en interpreteren wetenschapper gegevens?
- Waarom hoeven cellen niet continu grote hoeveelheden van elk enzym te produceren?
- Welke verbinding die is afgeleid van glucose komt daadwerkelijk de Krebs -cyclus binnen?
- Oorlog verstoort de natuur permanent, studie vondsten
- Wat is het verschil tussen antebrachium en brachium?
- Als gevaarlijke gifstoffen fundamentele biologie onderwijzen
- Hoe leidt de natuurlijke selectie tot evolutie van een populatie?
- Chemisch ingenieur ontwikkelt styreenvrije bio-hernieuwbare harsen

- Multifunctionele droom keramische matrixcomposieten zijn geboren

- Titan-supercomputer analyseert bacterieel fotosynthesesysteem
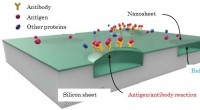
- Een halfgeleiderchip detecteert antigeenconcentraties bij 1 delen per quadriljoen molmassa
- Dwazen goud kan toch waardevol zijn

 Is 135 hoog voor alkalisch fosfaat?
Is 135 hoog voor alkalisch fosfaat?  Wat is de planeet die rond de zon reist?
Wat is de planeet die rond de zon reist?  Welke planeet is een groot lichaam en draait de zon?
Welke planeet is een groot lichaam en draait de zon?  Een nieuwe benadering voor dimensionale engineering van covalente organische raamwerken afgeleide koolstofatomen
Een nieuwe benadering voor dimensionale engineering van covalente organische raamwerken afgeleide koolstofatomen  Onderzoekers passen E. coli aan om planten om te zetten in hernieuwbare chemicaliën
Onderzoekers passen E. coli aan om planten om te zetten in hernieuwbare chemicaliën Door poreus materiaal kunnen autonome onderwatervoertuigen verder reizen
Door poreus materiaal kunnen autonome onderwatervoertuigen verder reizen Wat is het klimaat van Mars?
Wat is het klimaat van Mars?  Is Calderas de grootste vulkaan in Hawaii?
Is Calderas de grootste vulkaan in Hawaii?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

