
Wetenschap
Hoe voldoet een chemische reactie aan de wet van behoudsmassa?
1. Atomen worden niet gemaakt of vernietigd: Chemische reacties omvatten de herschikking van atomen, niet hun creatie of vernietiging. Atomen veranderen gewoon hun bindingspartners.
2. Herschikking van atomen: In een reactie worden bindingen tussen atomen in de reactanten verbroken en worden nieuwe bindingen gevormd om de producten te maken. Deze herschikking verandert niet het totale aantal betrokken atomen.
3. Behoud van massa: Omdat het aantal atomen tijdens de reactie constant blijft, moet de totale massa van de reactanten gelijk zijn aan de totale massa van de producten. Dit komt omdat de massa van elk atoom hetzelfde blijft, ongeacht de bindingsregeling.
Voorbeeld:
Overweeg de eenvoudige reactie van waterstofgas (H₂) die reageert met zuurstofgas (O₂) om water te vormen (H₂o):
2h₂ + o₂ → 2h₂o
* reactanten: 4 waterstofatomen en 2 zuurstofatomen
* Producten: 4 waterstofatomen en 2 zuurstofatomen
Het aantal atomen van elk element blijft hetzelfde aan beide zijden van de vergelijking. Daarom is de totale massa van de reactanten (waterstof en zuurstof) gelijk aan de totale massa van het product (water), wat de wet van het behoud van massa aantoont.
Belangrijke opmerking: Dit principe is van toepassing op gesloten systemen waar er geen uitwisseling van materie is met de omgeving. In open systemen kan massa verloren gaan of winnen door factoren zoals verdamping of de introductie van nieuwe stoffen.
 Als je zoutzuur rond de basis van een boom giet, zal dat dan de boom doden?
Als je zoutzuur rond de basis van een boom giet, zal dat dan de boom doden?  Wat gebeurt er wanneer objecten vrij vallen in de buurt van de aarde en het oppervlak?
Wat gebeurt er wanneer objecten vrij vallen in de buurt van de aarde en het oppervlak?  Het klimaat aanpassen om het te redden:wie beslist?
Het klimaat aanpassen om het te redden:wie beslist?  De manier waarop we water in ons lichaam transporteren, inspireert tot een nieuwe filtratiemethode
De manier waarop we water in ons lichaam transporteren, inspireert tot een nieuwe filtratiemethode  U hoeft niet diep te graven:nieuw gereedschap maximaliseert de extractie van goud en porfierkoper
U hoeft niet diep te graven:nieuw gereedschap maximaliseert de extractie van goud en porfierkoper
Hoofdlijnen
- Welke verbinding wordt tijdens regeneratie geproduceerd?
- Wat voor soort wetenschapper bestudeert motten?
- Een DNA -streng bevat de basissequentie AGTT. Wat is complementair DNA?
- De holle buizen van eiwitten die helpen bij het behouden van de vormcel is wat?
- Wat is de wetenschappelijke naam voor hond in Phylum?
- Normale menselijke gameten dragen hoeveel chromosomen?
- Indringende vraag:Wat doodt de honingbijen?
- Hoe keverlarven gedijen op aas
- De verschillen tussen mitochondriën en chloroplasten in structuur
- Voedsel- en drugsvervalsingen en fraude doorzien

- Gemodificeerde peptiden kunnen de groei en ontwikkeling van planten stimuleren
- Met een meerlagige aanpak, een filter om te voldoen aan de behoeften van de zoetwatervoorziening

- Nieuwe klasse zachte halfgeleiders kan HD-schermen transformeren
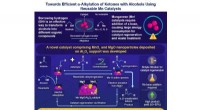
- Voordelige, herbruikbare Mn-katalysatoren zorgen voor een efficiënte alkylering van ketonen met alcoholen
 Jacaranda's in delen van Zuid-Afrika bloeien eerder:waarom is dit een waarschuwingssignaal
Jacaranda's in delen van Zuid-Afrika bloeien eerder:waarom is dit een waarschuwingssignaal  Aardbeving van vulkaan Etna schokt Sicilië, leidt tot paniek
Aardbeving van vulkaan Etna schokt Sicilië, leidt tot paniek Plastic
Plastic Welke planeet heeft een grootste massa als het stuk goud 1N woog?
Welke planeet heeft een grootste massa als het stuk goud 1N woog?  Welke spanningskrachten werken op een kroonluchter met twee kabels?
Welke spanningskrachten werken op een kroonluchter met twee kabels?  Wat is de kracht die de korst uit elkaar trekt?
Wat is de kracht die de korst uit elkaar trekt?  Heeft de onderliggende technologie van Bitcoin andere toepassingen? Beleggers denken van wel
Heeft de onderliggende technologie van Bitcoin andere toepassingen? Beleggers denken van wel  Nanodeeltjes kunnen DNA-schade veroorzaken door een celbarrière heen
Nanodeeltjes kunnen DNA-schade veroorzaken door een celbarrière heen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

