
Wetenschap
Wat is een gepolariseerd chloride -ion?
* Polarisatie: Dit verwijst naar een vervorming van de elektronenwolk in een atoom of ion. Het gebeurt wanneer een atoom of ion wordt blootgesteld aan een elektrisch veld, zoals wanneer het in de buurt van een ander atoom of ion is met een andere lading. Deze vervorming kan resulteren in een tijdelijk dipoolmoment, waarbij de ene kant van het atoom of ion iets positiever wordt en de andere kant iets negatiever wordt.
* chloride -ion: Dit is een negatief geladen ion, aangeduid als CL⁻. Het wordt gevormd wanneer een chlooratoom een elektron krijgt.
Mogelijke interpretaties van "gepolariseerd chloride -ion":
1. Polarisatie van een chloride -ion door een nabijgelegen kation: Wanneer een chloride -ion in de buurt van een positief geladen kation (zoals NA⁺) is, wordt de elektronenwolk van het chloride -ion naar het kation getrokken. Dit resulteert in een tijdelijk dipoolmoment binnen het chloride-ion, waarbij de zijde dichter bij het kation elektronenrijker wordt (enigszins negatief) en de andere kant wordt meer elektronen-deficiënt (enigszins positief). Dit effect staat bekend als ionische polarisatie .
2. chloride -ion in een polair oplosmiddel: Wanneer een chloride-ion wordt opgelost in een polair oplosmiddel zoals water, kunnen de oplosmiddelmoleculen interageren met het chloride-ion door dipool-ion interacties . Dit kan leiden tot een tijdelijke vervorming van de elektronenwolk van het chloride -ion, waardoor deze enigszins gepolariseerd is.
Het is belangrijk om te onthouden dat het chloride -ion zelf niet "gepolariseerd" is in de zin dat het permanent een positieve of negatieve lading krijgt. De polarisatie -effecten zijn tijdelijk en zijn het gevolg van interacties met andere geladen soorten.
Als u meer context of een specifiek voorbeeld zou kunnen geven, kan ik mogelijk een specifieker antwoord geven.
 Welke menselijke handeling kan een omgeving veranderen?
Welke menselijke handeling kan een omgeving veranderen?  Connector-schimmels bieden nieuwe aanwijzingen voor het lot van stikstof in opwarmende toendra
Connector-schimmels bieden nieuwe aanwijzingen voor het lot van stikstof in opwarmende toendra Welke invloed heeft de aardevolutie op zijn seizoenen?
Welke invloed heeft de aardevolutie op zijn seizoenen?  Vulkaan Alaska zendt aswolk uit Aleoeten
Vulkaan Alaska zendt aswolk uit Aleoeten Uit onderzoek blijkt dat omgevingsomstandigheden van invloed waren op de manier waarop vroege mensen over continenten migreerden
Uit onderzoek blijkt dat omgevingsomstandigheden van invloed waren op de manier waarop vroege mensen over continenten migreerden
Hoofdlijnen
- Apenstudie toont een pad naar het monitoren van bedreigde diersoorten
- Science Fair Project Ideas: Equine
- Het eten van insecten kan goed zijn voor de planeet. Europeanen zouden er meer van moeten eten
- Waarom wetenschappelijke apparaten gebruiken?
- Hoe de blauwe economie de toekomst van de Canadese oceanen en kustgemeenschappen zal bepalen
- Wat is een eenvoudige bacterie?
- Zal een cel door binaire splijting of mitose en cytokinese doorlopen om nieuwe cellen te produceren?
- Wat betekent het als ze zeggen dat massa in een mengsel wordt behouden?
- Onderzoekers ontdekken hoe wombats kakblokjes uitscheiden
- Close-ups van korrelgrenzen onthullen hoe zwavelonzuiverheden nikkel broos maken

- Silaan reguleert de thermische geleidbaarheid van composieten op moleculair niveau
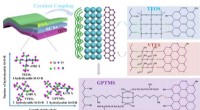
- Nieuwe methode kan leiden tot betere in vivo medicijnafgifte

- Fotochrome bismutcomplexen zijn veelbelovend voor optische geheugenelementen

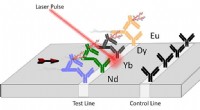
- Nieuwe technologie voor detectie van pathogenen aangedreven door lasers
 Wat is de magnitude van Neptunus in vergelijking met andere planeten in ons zonnestelsel?
Wat is de magnitude van Neptunus in vergelijking met andere planeten in ons zonnestelsel?  Nieuwkomers en Canadese middelbare scholieren zijn vriendelijk, maar geen vrienden
Nieuwkomers en Canadese middelbare scholieren zijn vriendelijk, maar geen vrienden Polar Vortex dompelt de VS in met kelderende, recordtemperaturen
Polar Vortex dompelt de VS in met kelderende, recordtemperaturen  Hoe burgerwetenschappers een atlas van schildpadden in Connecticut creëren
Hoe burgerwetenschappers een atlas van schildpadden in Connecticut creëren  Hoe heeft de fysieke geografie van Nubië de beschaving in de regio beïnvloed?
Hoe heeft de fysieke geografie van Nubië de beschaving in de regio beïnvloed?  Welke materialen zitten er in een telescoop?
Welke materialen zitten er in een telescoop?  Wat zijn de gebieden van het sediment waar een riviermond een vlak land op de bodem berg bereikt?
Wat zijn de gebieden van het sediment waar een riviermond een vlak land op de bodem berg bereikt?  Nieuwe nanotechnologie die de strijd tegen colorectale kanker en melanoom verbetert
Nieuwe nanotechnologie die de strijd tegen colorectale kanker en melanoom verbetert
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

