
Wetenschap
Als het aantal atomen elk element in producten gelijk is aan de vergelijking van reactanten is?
Hier is de uitsplitsing:
* Chemische reacties: In een chemische reactie worden atomen herschikt, niet gemaakt of vernietigd.
* Balancing -vergelijkingen: Een evenwichtige chemische vergelijking weerspiegelt dit principe. Het aantal atomen van elk element aan de reactantzijde (uitgangsmaterialen) moet gelijk zijn aan het aantal atomen van dat element aan de productzijde (resulterende stoffen).
Voorbeeld:
De reactie van waterstofgas (H₂) en zuurstofgas (O₂) om water te vormen (H₂o):
Onevenwichtige vergelijking: H₂ + O₂ → H₂o
Balanced vergelijking: 2h₂ + o₂ → 2h₂o
Verklaring:
* In de evenwichtige vergelijking zijn er 4 waterstofatomen (2 x 2) en 2 zuurstofatomen aan beide zijden van de vergelijking.
* De coëfficiënten (2 en 2) worden gebruikt om ervoor te zorgen dat het aantal atomen van elk element aan beide zijden gelijk is.
Dit principe is van fundamenteel belang voor de chemie en helpt ons te begrijpen hoe chemische reacties werken en hoe de uitkomst van reacties te voorspellen.
 Hoe zou u het aantal natriumionen berekenen dat aanwezig is in chloride van 38,1 gram?
Hoe zou u het aantal natriumionen berekenen dat aanwezig is in chloride van 38,1 gram?  Wat is een vast Purple-Black nonmetaal dat verandert in diep paars gas wanneer verwarmd?
Wat is een vast Purple-Black nonmetaal dat verandert in diep paars gas wanneer verwarmd?  Hoeveel gram H 2o wordt geproduceerd als 750 Fe wordt geproduceerd?
Hoeveel gram H 2o wordt geproduceerd als 750 Fe wordt geproduceerd?  Ingenieurs pionieren met het vormingsproces van platinagranaten, eerste waarneming ooit bereiken
Ingenieurs pionieren met het vormingsproces van platinagranaten, eerste waarneming ooit bereiken Welk element heeft een emissielijn bij 768 nm?
Welk element heeft een emissielijn bij 768 nm?
 De gevolgen van een vals nucleair alarm
De gevolgen van een vals nucleair alarm Het smelten van grote ijsbergen is een belangrijke fase in de evolutie van ijstijden
Het smelten van grote ijsbergen is een belangrijke fase in de evolutie van ijstijden NASA-studie vindt dat het vermogen van tropische bossen om koolstofdioxide te absorberen afneemt
NASA-studie vindt dat het vermogen van tropische bossen om koolstofdioxide te absorberen afneemt Beschrijf hoe natuurlijke selectie optreedt?
Beschrijf hoe natuurlijke selectie optreedt?  Scuba-duikende Kerstman brengt vakantievreugde voor vissen, museumbezoekers
Scuba-duikende Kerstman brengt vakantievreugde voor vissen, museumbezoekers
Hoofdlijnen
- Wat is een niet -voorbeeld van heterozygoot?
- Wat zijn de menselijke systemen in Rome?
- Waarom zijn mensen meer als dieren dan op planten?
- Waarom wisten vroege Grieken niet veel over het menselijk lichaam?
- De zes belangrijkste dinosaurusmythen en hoe we ze hebben ontkracht
- Wie is Angel Alcala en wat haar bijdrage als bioloog?
- Kunnen we de taal van onze neven en nichten van primaten decoderen?
- Wat Isa eukaryotisch?
- Welke organen beginnen met de letter c?
- Dit draagbare apparaat camoufleert zijn drager, ongeacht het weer

- Onderzoekers lokaliseren de grootste celreceptor van het lichaam
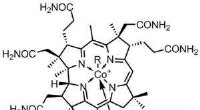
- Biomateriaal kan tand in leven houden na wortelkanaalbehandeling

- Onderzoekers brengen moleculen in beeld terwijl ze voor het eerst van lading veranderen
- Studie onthult onbekende details over veelgebruikte lithium-ionbatterijmaterialen
 Wat is de wetenschappelijke naam van luizen?
Wat is de wetenschappelijke naam van luizen?  Waarom je baas je niet bewust moet maken van je incompetentie
Waarom je baas je niet bewust moet maken van je incompetentie Wereldwijde schattingen van vervuiling onthullen verrassingen, mogelijkheid
Wereldwijde schattingen van vervuiling onthullen verrassingen, mogelijkheid Wat is het soortelijk gewicht van meg?
Wat is het soortelijk gewicht van meg?  Filmen hoe ons immuunsysteem bacteriën doodt
Filmen hoe ons immuunsysteem bacteriën doodt  Wat gebeurt er met hout wanneer verwarmd?
Wat gebeurt er met hout wanneer verwarmd?  Stervorming kan worden gestopt door koude geïoniseerde waterstof
Stervorming kan worden gestopt door koude geïoniseerde waterstof Wat is een gemeenschap die een stabiele fase van ecologische opvolging heeft bereikt?
Wat is een gemeenschap die een stabiele fase van ecologische opvolging heeft bereikt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

