
Wetenschap
Hoe worden de elf elektronen van natriumatoom gerangschikt?
Elektronenconfiguratie:
* 1S² 2S² 2P⁶ 3S¹
afbraak:
* 1S²: Het eerste energieniveau (n =1) heeft één subbleevel (s), die maximaal 2 elektronen kan bevatten. Dus, het 1s subbloed is gevuld met 2 elektronen.
* 2S²: Het tweede energieniveau (n =2) heeft ook een S -sub -niveau, dat is gevuld met 2 elektronen.
* 2p⁶: Het tweede energieniveau heeft ook een P -sub -niveau, dat maximaal 6 elektronen kan bevatten. Dit subbloed is volledig gevuld.
* 3S¹: Het derde energieniveau (n =3) heeft een S -sub -niveau, dat slechts 1 elektron bevat.
Vereenvoudigde weergave:
* [ne] 3S¹ Dit is een steno -notatie met behulp van de elektronenconfiguratie van het vorige edelgas (neon), [NE], gevolgd door het resterende elektron in het 3S -subel.
Sleutelpunten:
* energieniveaus: Elektronen zijn georganiseerd in energieniveaus, waarbij hogere aantallen hogere energieniveaus vertegenwoordigen.
* Subblevers: Binnen elk energieniveau zijn er subels (S, P, D, F) met verschillende vormen en energieën.
* Elektronenvulling: Elektronen vullen subels in volgorde van toenemende energie, volgens het AUFBAU -principe.
* valentie -elektron: Het buitenste elektron (3S¹) in natrium wordt het valentie -elektron genoemd en is verantwoordelijk voor de chemische reactiviteit van natrium.
Laat het me weten als je op een van deze punten meer details wilt!
 Wat is het doel van het definiëren van standaard enthalpies -formatie?
Wat is het doel van het definiëren van standaard enthalpies -formatie?  Welke oplossingen hebben een groter aantal hydroxide -ionen dan waterstofionen?
Welke oplossingen hebben een groter aantal hydroxide -ionen dan waterstofionen?  De moleculaire complexiteit van cellulaire machines en omgevingsprocessen ontrafelen
De moleculaire complexiteit van cellulaire machines en omgevingsprocessen ontrafelen Zullen sterke en snel wisselende kunstmatige spieren haalbaar zijn?
Zullen sterke en snel wisselende kunstmatige spieren haalbaar zijn? Kunnen koper en zwavel combineren in een verbinding?
Kunnen koper en zwavel combineren in een verbinding?
 Serpent Mound, Ohio:Binnen het archeologische mysterie
Serpent Mound, Ohio:Binnen het archeologische mysterie  Satelliet ziet kortstondige tropische cycloon Kirk
Satelliet ziet kortstondige tropische cycloon Kirk Microbiële remedies richten zich op chemische bedreigingen in het milieu
Microbiële remedies richten zich op chemische bedreigingen in het milieu Wetenschappers ontrafelen het effect van ENSO en Atlantische multidecadale oscillatie op de Oost-Aziatische wintermoesson
Wetenschappers ontrafelen het effect van ENSO en Atlantische multidecadale oscillatie op de Oost-Aziatische wintermoesson Studie kijkt naar kwetsbaarheid aardbeving San Francisco
Studie kijkt naar kwetsbaarheid aardbeving San Francisco
Hoofdlijnen
- Waarom is celspecialisatie belangrijk voor ongewervelde dieren?
- Welke hormoonachtige moleculen worden NIET uit arachidonzuur geproduceerd?
- Onderzoek werpt licht op hoe conflicterende processen plaatsvinden binnen een enkele cel
- Hoe worden enzymen gebruikt om diabetes te diagnosticeren?
- Zoeken embryo's naar hun eigen voedsel buiten het ei?
- Uit onderzoek blijkt hoe het ene enzym op het andere meelift om tRNA te herkennen
- Hoe gebruiken wetenschappers spectrografen?
- Onderzoekers bestuderen de pathobiologie van antibiotische nevenreacties
- Wat is Bioancy Force?
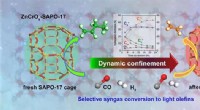
- Dynamische opsluiting van SAPO-17-kooien op selectiviteitscontrole van syngasconversie
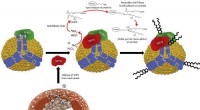
- Mogelijke bescherming tegen atherosclerose
- Ontdekking van ontgiftingsenzymen kan worden gebruikt om belangrijke gewasverontreinigingen aan te pakken

- Elektrische pulsen gebruiken voor vaccinefficiëntie
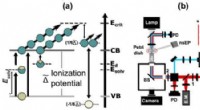
- Synthetische fysiologen ontwikkelen nieuwe receptor uitgeschakeld door groen licht

 Wie was de vader van taxonomie en hoe classificeerde hij levende organismen?
Wie was de vader van taxonomie en hoe classificeerde hij levende organismen?  Droge bliksem heeft Tasmanië in vuur en vlam gezet, en klimaatverandering maakt het waarschijnlijker dat het opnieuw gebeurt
Droge bliksem heeft Tasmanië in vuur en vlam gezet, en klimaatverandering maakt het waarschijnlijker dat het opnieuw gebeurt Franse autofabrikant PSA trotseert verkoopvertraging met recordwinsten
Franse autofabrikant PSA trotseert verkoopvertraging met recordwinsten Wie ontdekte de planetaire afstemming?
Wie ontdekte de planetaire afstemming?  Wat is de massa van 0,05 mol zuurstof?
Wat is de massa van 0,05 mol zuurstof?  Nieuwe warme Jupiter-exoplaneet ontdekt
Nieuwe warme Jupiter-exoplaneet ontdekt Welke stervende gigantische ster kan plotseling ontploffen worden?
Welke stervende gigantische ster kan plotseling ontploffen worden?  Leven bevroren in de tijd onder een elektronenmicroscoop krijgt Nobelprijs
Leven bevroren in de tijd onder een elektronenmicroscoop krijgt Nobelprijs
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

