
Wetenschap
Hoe breng je deze vergelijking SNO2 plus H2 --- sn h2o in evenwicht?
1. Identificeer de reactanten en producten:
* reactanten: Sno₂ (tinoxide) en H₂ (waterstofgas)
* Producten: Sn (tin) en h₂o (water)
2. Tel atomen aan elke kant:
| Element | Reactanten | Producten |
| --- | --- | --- |
| Sn | 1 | 1 |
| O | 2 | 1 |
| H | 2 | 2 |
3. Breng de zuurstofatomen in evenwicht:
* Er zijn 2 zuurstofatomen aan de reactantzijde en slechts 1 aan de productzijde.
* Voeg een coëfficiënt van 2 toe voor h₂o:
Sno₂ + h₂ → sn + 2h₂o
4. Breng de waterstofatomen in evenwicht:
* Nu hebben we 4 waterstofatomen aan de productzijde en 2 aan de reactantzijde.
* Voeg een coëfficiënt van 2 toe voor H₂:
Sno₂ + 2h₂ → sn + 2h₂o
5. Controleer op een evenwichtige vergelijking:
* Sn:1 aan elke kant
* O:2 aan elke kant
* H:4 aan elke kant
De gebalanceerde chemische vergelijking is:
Sno₂ + 2h₂ → sn + 2h₂o
 Nieuwe ontdekkingen van diepzeedieren rechtvaardigen uitgebreide bescherming in Costa Ricaanse wateren
Nieuwe ontdekkingen van diepzeedieren rechtvaardigen uitgebreide bescherming in Costa Ricaanse wateren Hoe bosbranden en het weer de Portugese volksgezondheid beïnvloeden
Hoe bosbranden en het weer de Portugese volksgezondheid beïnvloeden  Wat zijn de overeenkomsten tussen een bladverliezend bos en tropisch regenwoud?
Wat zijn de overeenkomsten tussen een bladverliezend bos en tropisch regenwoud?  Fruitvliegjes:zomerplaag of wetenschappelijk wonder?
Fruitvliegjes:zomerplaag of wetenschappelijk wonder?  Tropische woestijndieren & planten
Tropische woestijndieren & planten
Hoofdlijnen
- Welke term identificeert het proces dat door cel wordt gebruikt om grote moleculen binnen te brengen?
- Wat stelt organismen in staat om het proces van natuurlijke selectie in hun omgevingen te overleven?
- Hoe helpen klimatografen onze biomes te begrijpen?
- Wat is het verschil tussen mitose en cytokines?
- Op welke manieren zijn de cellen van planten en dieren verschillend van eencellige eukaryoten?
- Welk effect heeft de temperatuur op cellulaire enzymactiviteit?
- Waarom zijn de nakomelingen van oudere moeders minder geschikt om lang en voorspoedig te leven?
- Wat zijn haarachtige projecties aan de buitenkant van cellen?
- Wat is het doel van wetenschappelijke sondes?
- Shine a light:nieuw onderzoek laat zien hoe energiezuinig licht plastic kan buigen

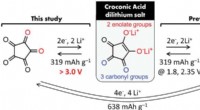
- Een 4 V-klasse metaalvrije organische lithium-ionbatterij komt dichter bij de realiteit
- Een eenvoudige manier om complexe halfgeleiders zichzelf te laten assembleren
- Onderzoekers zetten niet-giftige resten om in coating die slijtvast is, vlek en zonlicht

- Pentaceenderivaat heeft 100 keer meer lichtbestendigheid dan conventionele producten

 Hoe sterk is de zwaartekracht op Mars?
Hoe sterk is de zwaartekracht op Mars?  Wanneer warmte wordt geleverd aan een vaste stof, wat gebeurt er de energie?
Wanneer warmte wordt geleverd aan een vaste stof, wat gebeurt er de energie?  Hoe verschilt de kristallijne structuur van een metaal van een ionische verbinding zoals natriumchloride of cesiumchloride?
Hoe verschilt de kristallijne structuur van een metaal van een ionische verbinding zoals natriumchloride of cesiumchloride?  Beschrijf de experimentele basis om te geloven dat nucleus een zeer kleine fractie volume -atoom bezet?
Beschrijf de experimentele basis om te geloven dat nucleus een zeer kleine fractie volume -atoom bezet?  Wat is de relatie tussen hernieuwbaar en onuitputtelijk?
Wat is de relatie tussen hernieuwbaar en onuitputtelijk?  Wat zijn 3 effecten van chemische verwering?
Wat zijn 3 effecten van chemische verwering?  Welke energie geven alle objecten af?
Welke energie geven alle objecten af?  Wat is water in een vaas verandert in damp?
Wat is water in een vaas verandert in damp?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

